
Vol. 39, n.º 1, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 1, 2006 |
REVISIONES
Francisco Nogales1, Catalina Buriticá2
1 Catedrático de
Anatomía Patológica, Universidad de Granada.
2 Patóloga anatómica y
clínica de la Universidad Nacional de Colombia, Bogotá. Becaria «Hernando
Salazar» de la International Society of Gynecologic Pathologists.
fnogales@ugr.es
BIOPSIA ENDOMETRIAL, IMPACTO CLÍNICO
Desde su introducción en Alemania a finales del siglo XIX, la biopsia endometrial (BE) representa una de las exploraciones anatomopatológicas mas utilizadas en la práctica diaria. Por su facilidad de acceso ha sido una manera rápida y económica de realizar un diagnóstico de las enfermedades uterinas. Los ginecólogos, junto con los dermatólogos son históricamente pioneros en las técnicas de biopsia.
Durante muchos años la biopsia endometrial ha representado el patrón oro diagnóstico. Sin embargo, la cuantificación de los niveles hormonales en sangre supuso un parcial abandono de la BE en el campo de las llamadas hemorragias funcionales. Igualmente ocurrió en el campo de la infertilidad donde, desaparecida la tuberculosis (1), la BE pasó a ocupar un papel secundario en la valoración diagnóstica de estas pacientes. Las dudas clínicas y las indudables molestias asociadas con la toma de la biopsia supusieron un declinar de esta exploración en las décadas de los 80 y 90.
BIOPSIA ENDOMETRIAL ASPIRATIVA (BEA) Y MENOPAUSIA
Solamente en época reciente, con la introducción de distintos tipos de tratamientos durante la menopausia tanto hormonales sustitutivos (2,3) como de terapia de tumores mamarios (4) y su consiguiente monitorización, se han actualizado las técnicas de biopsia, especialmente formas mínimamente invasivas tales como la biopsia endometrial aspirativa (BEA) mediante Pipelle de Cornier o la menos difundida Ipas MVA (5) etc. La BEA representa la técnica mas utilizada hoy en día en Europa. Otros países del primer y del tercer mundo sobre todo, aun aplican técnicas biopsicas clásicas.
La introducción de la BEA ha supuesto una mayor rapidez de ejecución ambulatoria y economía de recursos así como una mínima molestia a la paciente (6). Así, podemos decir que la BEA ha vuelto a poner de moda la biopsia endometrial.
BEA Y ECOGRAFÍA (7-9)
Durante una época y como resultado de la cada vez mayor exactitud y fiabilidad de la ecografía vaginal, se llegó a pensar que la biopsia endometrial cedería terreno a la ecografía, al conseguir esta última delimitar un grosor endometrial diagnóstico que permitiría prescindir de la biopsia, exploración que suponía un tiempo mayor de consulta medica e incluso, en algunos casos, un breve ingreso hospitalario. Sin embargo, existen numerosos estudios que demuestran que la biopsia endometrial posee mayor sensibilidad y especificidad diagnostica que la ecografía sola. Utilizando niveles diagnósticos ecográficos de corte de 4 y 5mm de grosor endometrial no es posible diagnosticar lesiones que sin embargo, se ponen en manifiesto en la toma biopsica (fig. 1). Distintos estudios (7-9) prueban que la biopsia endometrial sigue siendo el patrón oro frente a cualquier técnica imagenologica.
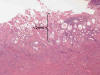
Fig 1:
Falsos negativos en ecografía. Endometrio atrófico de menos de 2 mm con
carcinoma papilar creciendo en superficie. No detectable en ecografía.
BEA Y RELACIÓN ANATOMOCLÍNICA
La BEA ha ocupado con ventaja tanto el discutible papel diagnóstico de la citología endometrial como el de la biopsia invasiva de la cánula de Novak, Vabra etc. Sin embargo, es correcto argumentar que el material obtenido es fragmentado y escaso; muy distinto al provisto por las técnicas clásicas de biopsia. Por esta razón, el pátologo debe conocer las ventajas y limitaciones de esta técnica y sacar el máximo partido en el diagnóstico. A pesar de la escasez del material, se puede decir que en una práctica normal, el porcentaje de muestras valorables supera el 97%, razón por la cual el patólogo debe evitar en lo posible diagnósticos de material ausente, ininterpretable o insuficiente (10, 11).
La interpretación de la BEA exige una muy estrecha relación entre histopatólogo y ecografista ya que el diagnóstico final tiene obligatoriamente que ser integrado con el de los ultrasonidos.
Para sacar el máximo provecho a la biopsia, es una obviedad mencionar que el ginecólogo debe proveer un mínimo de datos para poder permitir un diagnóstico: edad y razón por la cual se realiza la BEA (paciente sintomática o no), tiempo de menopausia y tipo de tratamiento, e idealmente, hallazgos ecográficos.
Desde un punto de vista histológico, el material obtenido por la BEA mantiene bien la relación glándula-estromal y si se realiza adecuadamente, se biopsia una superficie mayor que otras técnicas. El problema de la BEA radica sobre todo en los falsos negativos condicionados por la focalidad de lesiones endometriales tales como cambios atípicos, pólipos, miomas submucosos, etc. (fig. 2). De todos modos, ante cualquier duda o reserva diagnóstica es necesario requerir una exploración invasiva bien histeroscópica o legrado de cavidad.

Fig 2:
Falsos negativos en BEA: Endometrio con lesión focal atípica no detectada por la
biopsia aspirativa.
Para extraer la máxima información del material de la BEA, debe incluirse la totalidad del material con sangre, moco y detritus. Los artefactos de biopsia suelen ser frecuentes, sobre todo si la toma se ha adherido a gasa o ha sido incorrectamente manipulada.
BEA: VALORACIÓN HISTOLÓGICA E INTERPRETACIÓN CONJUNTA
Para el diagnóstico de lesiones asociadas a la toma de los distintos tipos de terapia hormonal de sustitución (THS) y tamoxifeno, utilizamos las siguientes categorías histopatológicas basadas, en parte, en la clasificación de lesiones endometriales propuesta por la OMS. Es necesario advertir que es una ficción intentar adscribir una histología característica a cada uno de los distintos preparados utilizados en los THS.
Categorías histopatológicas utilizadas:
0. No se ha obtenido o identificado tejido
Esta situación es realmente infrecuente, ocurriendo en apenas 1% de las tomas biopsicas.
1. Tejido insuficiente para diagnóstico
La frecuencia de este evento es del 13%. Microscópicamente se observa material correspondiente a moco, polinucleares y tiras de epitelio exo o endocervical, fácilmente identificable este último por su citoplasma basófilo y polarización nuclear (fig. 3). El hecho de no encontrar fragmentos endometriales no significa que no se haya biopsiado la cavidad endometrial, ya que el endometrio puede haber quedado reducido a una mínima banda que apenas deja desprender escasísimo material (fig. 4). Este diagnóstico necesita obligatoriamente integrarse con la información de ultrasonidos: si la ecografía muestra un endometrio lineal, sin lesiones focales, con medidas no superiores a los 4 mm (en doble capa) se debe considerar, aun en ausencia de tejido endometrial, como una atrofia.
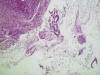
Fig 3:
Material insuficiente compuesto por fragmento muscular, moco y tiras de epitelio
cervical.

Fig 4:
Zona de biopsia aspirativa (flecha) El endometrio es tan delgado que apenas es
evidente: ello explica en parte el diagnóstico de material insuficiente: aunque
se ha llegado a cavidad, apenas hay endometrio debido a la atrofia.
3. Endometrio atrófico
Es sin duda el diagnóstico mas frecuente en la BEA de la menopausia (70%), especialmente en pacientes recibiendo THS de tipo combinado. La tibolona y la mayor parte de los fitoestrogenos y los moduladores selectivos de los receptores estrogénicos (SERMs) se asocian, casi siempre, a este tipo de endometrio.
Histopatológicamente observamos tiras o cintillas epiteliales correspondientes al epitelio endometrial superficial. En ellas los núcleos se sitúan en una sola fila en posición indiferente. Los citoplasmas son escasos. (fig. 5). En ningún momento existe actividad mitótica, situación que siempre hay que comprobar utilizando el gran aumento. Ocasionalmente, es posible ver algunas placas epiteliales análogas a las encontradas en la citología exfoliativa endometrial. El estroma es apenas visible y es de tipo denso y basófilo. Ocasionalmente encontramos pequeños quistes y característicos de la de atrofia quística y de la lesión difusa quística del tratamiento prolongado de tamoxifeno (fig. 6). Los quistes están rellenos de material basófilo o calcificaciones.
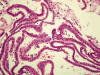
Fig 5:
Tiras de epitelio atrófico de superficie.
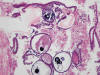
Fig 6:
Quistes de atrofia; también son frecuentes en lesions de tamoxifeno.
Para realizar el diagnóstico de atrofia, no es necesario que el espécimen tenga gran cantidad de tiras epiteliales, ya que se supone que si existe atrofia, esta será universal en toda la mucosa endometrial. Como en toda exploración en la que realiza una toma parcial –en este caso, superficial–, el ginecólogo debe estar advertido de la posibilidad, si bien remota, de falsos negativos.
4. Endometrio proliferativo
Esta categoría se observa en el 6% de endometrios postmenopáusicos, y pueden estar asociados a cualquier THS (habitualmente a los de tipo combinado, secuencial o tamoxifeno y menos frecuentemente a fitoestrógenos y tibolona). Observamos tanto fragmentos compuestos por estroma y glándulas, así como glándulas sueltas. En nuestra experiencia es muy frecuente encontrar estas últimas esparcidas por toda la toma. El estroma, cuando existe, suele ser laxo y raramente puede mostrar alguna mitosis. El epitelio glandular es seudoestratificado con células de citoplasma de mayor amplitud que en la atrofia y núcleos en los que se detectan mitosis (fig. 7). El hallazgo de una sola mitosis automáticamente coloca a la muestra en esta categoría. No somos partidarios de utilizar la valoración propuesta por la Food and Drug Administration norteamericana (US FDA) para diagnóstico de proliferación endometrial en las categorías de proliferación débil, proliferación activa y proliferación desordenada. Las dos primeras representan básicamente la misma situación (actividad estrogénica no opuesta) y la última, no incluida la OMS, es indistinguible de una hiperplasia simple.
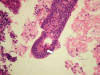
Fig 7:
Endometrio proliferativo: glándulas sueltas con mitosis (flecha).
Para el ginecólogo que monitoriza un THS le interesa fundamentalmente si existe proliferación o no, ya que este dato, de acuerdo con un grosor ecográfico aumentado, puede indicar el cambio de dosis o de tipo de terapia, especialmente en pacientes sintomáticos. Es conveniente recordar que el diagnóstico de endometrio proliferativo es el más frecuentemente realizado en pacientes con metrorragia en THS. Con frecuencia, en los THS tanto secuenciales como combinados, las glándulas proliferativas, con mitosis, adoptan cambios funcionales simultáneos de tipo secretor, tales como vacuolas tanto apicales como basales (fig. 8). Para este tipo de endometrio no debe emplearse la terminología de endometrio mixto o maduración irregular sino el de proliferativo, que es el que realmente tiene significación clínica.

Fig 8:
Endometrio proliferativo con mitosis (flecha) pero con glándulas de tipo
secretor exhibiendo vacuolas.
El endometrio proliferativo es hallazgo frecuente en tratamiento de tamoxifeno y mucho más raro en pacientes en régimen de tibolona, fitoestrógenos o SERMs.
5. Endometrio secretor/progestacional
Esta categoría tiene lugar en el 5% de las biopsias aspirativas postmenopáusicas y depende lógicamente del tipo de terapia utilizada (dosis y tipo de gestágeno) (14). La terapia combinada determina endometrios con marcada atrofia glandular y estroma decidualizado (fig. 9) de análoga forma a lo observado en pacientes sujetos a contracepción hormonal oral. En dispositivos intrauterinos con liberación local de progesterona utilizados para controlar sangrado postmenopáusico (Mirena) (15) la morfología es idéntica.
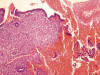
Fig 9:
Endometrio progestacional con atrofia glandular y pseudodecidualización
estromal. Flotando en la sangre se hallan tiras de epitelio superficial
atrófico.
Asociados a terapia secuencial podemos observar a veces endometrios secretores de tipo prácticamente cíclico, bien balanceados en la relación glándulo-estromal.
Debido a la atrofia glandular presente en endometrios de terapia combinada y en biopsia superficial, los hallazgos histológicos pueden ser totalmente indistinguibles de un endometrio atrófico (fig. 9). Ambos diagnósticos son pues correctos y su diferenciación no posee significación clínica.
6. Endometrio menstrual (descamativo)
Los endometrios de tipo menstrual (descamativo) corresponden a un 5% de biopsias perimenopáusicas y suelen ser una fuente muy frecuente de confusión y defectos interpretativos histopatológicos. Encontramos endometrios de este tipo en la mayor parte de biopsias realizadas tanto en pacientes con sintomatología de metrorragia con THS combinado como en el de tipo secuencial. El material recibido (fig. 10) está fragmentado, colapsado, encogido, densamente basófilo, y asociado a gran cantidad de sangre y detritus. No se suele observar mucha inflamación. Son características las bolas de estroma desnudo con trombos fibrinosos. El mayor problema de interpretación de estas biopsias radica en las masas celulares epiteliales sincitiales eosinófilas que se encuentran sueltas o rodeando islotes de estroma basófilo. Estas células, interpretadas en la literatura como «metaplasia eosinofila, de células claras, de células en tachuela, etcétera» (16-18) no representan sino las células regenerativas que han de reparar la herida menstrual y como tales, presentan atipia nuclear, a veces muy marcada (19), e incluso mitosis. La atipia puede ser tan notable (fig. 11) que puede inducir a un diagnóstico diferencial con carcinomas endometriales de alto grado de tipo seroso, habitualmente positivos a p53. El epitelio regenerativo produce con frecuencia configuraciones papilares que pueden inducir a confusión con alguna neoplasia de tipo papilar.
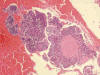
Fig 10:
Endometrio menstrual con bolas estromales desnudas, trombosis y epitelio de
regeneración superficial.
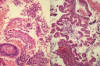
Fig 11:
Tiras de epitelio regenerativo con irregularidda nuclear (izquierda) y
configuración papilar (derecha).
6. Pólipos endometriales
Tienen lugar en 3% de pacientes perimenopausicas. Con frecuencia se aspiran con la cánula pequeños pólipos enteros que dejan pocas dudas diagnosticas al hallarse rodeados de epitelio, excepto en el pedículo de implantación donde se sitúan gruesos ramos vasculares. El estroma es denso, fibroso y las glándulas, frecuentemente paralelas a la superficie, pueden adoptar ramificaciones peculiares, especialmente en el caso de pacientes tratadas con tamoxifeno que también pueden presentar algunas imágenes de metaplasia mucinosa o ciliar.
La fragmentación de pólipos es la regla en biopsia aspirativa aunque ocasionalmente se obtienen cilindros aspirados completos (fig. 12). Es bien conocido que los pólipos son frecuentemente fuente de confusión con lesiones tales como las hiperplasias simples o complejas. La clave diferencial viene dada por los característicos componentes estromales y vasculares. En algunos casos, sin embargo la diferenciación de entidades es muy difícil, sobre todo en pólipos con cambio funcional o atípico focal.
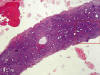
Fig 12:
Polipo endometrial aspirado como cilindro. La clave diagnóstica reside en el
denso estroma y gruesos ramos vasculares (recuadro).
Es necesario especificar en el informe histopatológico, aparte del pólipo, la morfología del endometrio acompañante, habitualmente atrófico. Una vez extirpado el pólipo de histología habitual, preferiblemente mediante histeroscopia, si el endometrio acompañante es atrófico, la paciente puede reanudar el THS.
La patología secundaria del pólipo es infrecuente, aunque hay que prestar atención a posibles degeneraciones carcinomatosas (tanto carcinomas de tipo endometrioide como los de tipo seroso), sobre todo en pacientes con tratamiento prolongado con tamoxifeno.
7. Hiperplasia Simple
Se presenta como un rara contingencia (0,8%) asociada a THS perimenopausico. Su presencia presupone siempre la cesación del tratamiento.
Debido a las características de fragmentación de la BEA, es este un diagnóstico relativamente complicado ya que el material desagregado altera la imagen arquitectural habitual de la hiperplasia simple (fig. 13). Podemos verla como islotes con abundante estroma, algunas glándulas dilatadas y tendencia a la confluencia glandular. Muchas veces la distinción con un endometrio proliferativo es muy difícil, al igual que lo que ocurre con fragmentos de pólipos. Como hemos mencionado anteriormente, el diagnóstico de endometrio proliferativo desordenado no hace sino complicar el manejo clínico de la paciente.
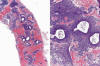
Fig 13:
Hiperplasia simple desagregada por la aspiración (ecografía 9 mm). Imágenes
quísticas con abundante estroma.
Por la relevancia del diagnóstico, se debe integrar el resultado con la imagen ecográfica, teniendo particular importancia el grosor e irregularidad endometrial. En algunos casos, técnicas ecográficas simples como la observación tras dilatación de la cavidad con suero salino, pueden ayudar a identificar los pólipos endometriales y descartar este diagnóstico.
La hiperplasia simple suele desaparecer tras la interrupción del THS y debe, sin embargo, seguirse ecográficamente. La biopsia de seguimiento no suele necesaria.
8. Hiperplasia compleja
9. Hiperplasia atípica
Consideraremos, a efectos interpretativos, estas dos categorías de modo conjunto. Estas situaciones ocurren en apenas 0,3% y 0,2% respectivamente de biopsias postmenopáusicas en THS. Ambos tipos de hiperplasia suelen ser lesiones focales (20) que coexisten bien con endometrios proliferativos o con imágenes de hiperplasia simple. Las glándulas son de arquitectura angular e irregular y confluyen en focos dejando mínima cantidad de estroma (fig. 14). La atipia nuclear del epitelio es el rasgo que diferencia entre ambos tipos de hiperplasia. Sin embargo, es difícil valorar la atipia si no la consideramos contextualmente, en comparación con zonas de endometrio de arquitectura regular o normal. Ese es el gran problema de diferenciación entre estos dos tipos de hiperplasia y a ello se debe los grandes problemas de falta de reproducibilidad inter- e intraobservador de estos dos diagnósticos (21-27). Las morulas de epitelio plano se asocian habitualmente con lesiones con complejidad glandular y contribuyen a veces a establecer un diagnóstico de hiperplasia compleja con o sin atipia.
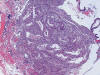
Fig 14:
Hiperplasia compleja con marcada irregularidad y confluencia glandular.
El diagnóstico diferencial de estos tipos de hiperplasia es frecuentemente con pólipo endometrial.
10. Carcinoma endometrioide (tipo 1)
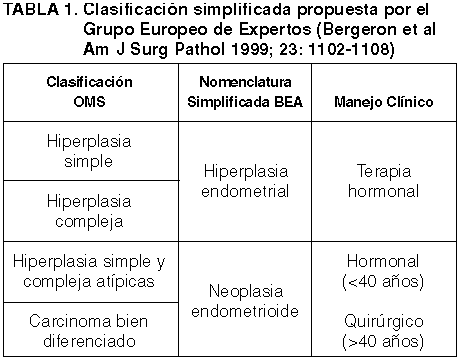
Destacaremos sobre todo el diagnóstico, íntimamente ligado con la categoría anterior, de adenocarcinomas endometrioides altamente diferenciados (28,29), muchos de ellos indistinguibles, cuando no solapados, con hiperplasia atípica. Es para estos casos cuando se propone, por su reproducibilidad y fácil uso clínico, la aplicación de la terminología del Grupo de Expertos Europeos de «neoplasia endometrioide», (22) (tabla 1) especialmente pensada para diagnósticos sobre material de BEA. Debido a la limitación de la cantidad y calidad de material, con frecuencia no es posible establecer una clara diferenciación entre hiperplasia y carcinoma bien diferenciado, hecho por lo demás de solo relativa importancia clínica, ya que ambas situaciones se consideran como neoplásicas y suponen, en la perimenopausia, una terapia quirúrgica análoga (histerectomía). La reciente terminología de neoplasia endometrial intraepitelial (EIN, NIE) (21,23) no se suele aplicar, por ser complicada y poco reproducible, fuera de reducidos círculos.
Es preciso tener en cuenta que los adenocarcinomas pueden ocurrir asociados a cualquier tipo de THS, incluido tibolona (30).
11. Carcinoma de histología no endometrioide.
Es raro ver este tipo de tumores (31) asociados a THS, ya que suelen ser mas frecuentes en pacientes no tratadas de edad avanzada.
La biopsia aspirativa permite un rápido diagnóstico de carcinomas de tipo seroso o de células claras debido al crecimiento habitualmente en superficie de dichos tumores (fig. 1). Se han descrito asociados a tratamientos prolongados con tamoxifeno (32- 34), a veces originados en pólipo endometrial. Algunos casos de tumores de alto grado con marcada atipia nuclear pueden simular los fenómenos regenerativos mencionados en la descamación endometrial. En estos carcinomas la positividad nuclear a p53 (35) es la norma.
12. Miscelánea
La biopsia aspirativa es diagnostica en casos de endometritis (36-38) tanto inespecífica como granulomatosa. En la primera el infiltrado inflamatorio, con células plasmáticas, se sitúa en el estroma aunque en las luces glandulares pueden hallarse microabscesos. La emperipolesis de células inflamatorias atravesando el epitelio glandular es siempre diagnóstica. Los folículos linfoides estromales suelen carecer de significado, salvo en situaciones de riesgo de tuberculosis endometrial (1). Los granulomas epitelioides de distintos procesos (1,37) (tuberculosis, sarcoidosis, coccidiosis, etcétera) son diagnósticos.
Es posible encontrar en biopsias aspirativas de pacientes menopausicas (algunas de ellas con mas de 10 años de cesación del ciclo) nódulos secuestrados de antiguos lechos placentarios implantativos de embarazos previos. Están compuestos por un material homogéneo e hialino frecuentemente calcificado en el que se puede encontrar todavía células –curiosamente atípicas- de trofoblasto extravilloso, positivas tanto a CD10 como a lactógeno placentario humano (hPL).
BIBLIOGRAFÍA
Nogales-Ortiz F, Tarancon I, Nogales FF Jr. The pathology of female genital tuberculosis. A 31-year study of 1436 cases.Obstet Gynecol. 1979; 53: 422-8.
Feeley KM, Wells M. Hormone replacement therapy and the endometrium. J Clin Pathol 2001; 54: 435-440.
Piegsa K, Calder A, Davis JA, McKay-Hart D, Wells M, Brylen F. Endometrial status in post-menopausal women on long-term continuous combined hormone replacement therapy (Kliofem). A comparative study of endometrial biopsy, outpatient hysteroscopy and transvaginal ultrasound. Eur J Obstet Gynecol Reprod Biol 1997; 72: 175-180.
Kennedy MM, Baigrie CF, Manek S. Tamoxifen and the endometrium : review of 102 cases and comparison with HRT – related and non-HRT – related endometrial pathology. Int J Gynecol Pathol 1999; 18: 130-137.
Técnicas biopsicas. http://www.ipas.org/english/publications/mva.asp, http://www.ccdlab.com/fam_depist_cancer/pipelle_cornier.htm.
Crum CP, Hornstein MD, Nucci MR. Hertig and beyond : a systematic and practical approach to the endometrial biopsy. Adv Anat Pathol 2003; 10: 301-318.
Lindgren R, Mattsson LA, Andersson K,et al Transvaginal ultrasonography and endometrial histology in peri- and postmenopausal women on hormone replacement therapy. Br J Obstet Gynaecol. 1999; 106: 421-6.
Meuwissen JH, Oddens BJ, Klinkhamer PJ. Endometrial thickness assessed by transvaginal ultrasound insufficiently predicts occurrence of hyperplasia during unopposed oestrogen use. Maturitas. 1996; 24: 21-30.
Smith-Bindman R, Weiss E, Feldstein V. How thick is too thick? When endometrial thickness should prompt biopsy in postmenopausal women without vaginal bleeding. Ultrasound Obstet Gynecol. 2004; 24: 558-65.
Phillips V, McCluggage WG. Results of a questionnaire regarding criteria for adequacy of endometrial biopsies. J Clin Pathol 2005; 58: 417-419.
Bakour SH, Khan KS, Gupta JK. Controlled analysis of factors associated with insufficient sample on outpatient endometrial biopsy. Br J Obstet Gynaecol 2000; 107: 1312-1314.
Modelska K, Cummings S. Tibolone for postmenopausal women: systematic review of randomized trials. J Clin Endocrinol Metab 2002; 87: 16-23.
FDA Guidance for Industry. Estrogen and Estrogen/Progestin Drug Products to Treat Vasomotor Symptoms and Vulvar and Vaginal Atrophy Symptoms — Recommendations for Clinical Evaluation. Center for Drug Evaluation and Research (CDER). January 2003.
Guarch R, Nogales FF, Bergeron C, Puras A. Menopausia y tratamiento hormonal sustitutorio. Rev Esp Patol 32: 41-47; 1999.
Phillips V, Graham CT, Manek S, McCluggage WG. The effects of the levonorgestrel intrauterine system (Mirena coil) on endometrial morphology. J Clin Pathol 2003; 56: 305-307.
Hendrickson MR, Kempson RL. Endometrial epithelial metaplasias: proliferations frequently misdiagnosed as adenocarcinoma. Report of 89 cases and proposed classification. Am J Surg Pathol 1980; 4: 525-542.
Zaman SS, Mazur MT. Endometrial papillary syncytial change : a nonspecific alteration associated with active breakdown. Am J Clin Pathol 1993; 99: 741-745.
Lehman MB, Hart WR. Simple and complex hyperplastic papillary proliferations of the endometrium: a clinicopathologic study of nine cases of apparently localised papillary lesions with fibrovascular stromal cores and epithelial metaplasia. Am J Surg Pathol 2001; 25: 1347-1354.
Nogales-Ortiz F, Puerta J, Nogales FF. The normal menstrual cycle. Chronology and mechanism of endometrial desquamation.Obstet Gynecol. 1978; 51: 259-64.
Silverberg SG, Kurman RJ, Nogales FF.et al Epithelial tumours and related lesions of the uterine corpus (4.1) WHO Classification of Tumours (Blue Books). III. Pathology and Genetics of Tumours of the Breast and Female Genital Organs. Edited by F.A.Tavassoli and M.R. Stratton. IARC Lyon 2003.
Baak JPA, Mutter GL. EIN and WHO 94. Considering the classification of endometrial hyperplasia. J Clin Pathol 2005; 58: 1-6.
Bergeron C, Nogales FF, Masseroli M, et al. Multicentric European study testing the reproducibility of the WHO classification of endometrial hyperplasia with a proposal of a simplified working classification for biopsy and curettage specimens. Am J Surg Pathol 1999; 23: 1102-1108.
Hecht JL, Ince TA, Baak JP, et al. Prediction of endometrial carcinoma by subjective endometrial intraepithelial neoplasia diagnosis. Mod Pathol 2005; 18: 324-330.
Kendall BS, Ronnett BM, Isacson C, et al. Reproducibility of the diagnosis of endometrial hyperplasia, atypical hyperplasia, and well differentiated carcinoma. Am J Surg Pathol 1998; 22: 1012-1019.
Mutter GL. The Endometrial Collaborative Group. Endometrial intraepithelial neoplasia (EIN): will it bring order to chaos? Gynecol Oncol 2000; 76: 287-290.
Skov BG, Broholm H, Engel U, et al. Comparison of the reproducibility of the WHO classifications of 1975 and 1994 of endometrial hyperplasia. Int J Gynecol Pathol 1997; 16: 33-37.
Zaino RJ, Kauderer J, Trimble CL, Silverberg SG, Curtin JP, Lim PC, Gallup DG. Reproducibility of the diagnosis of atypical endometrial hyperplasia: a Gynecologic Oncology Group study. Cancer. 2006; 106: 804-11.
Alkushi A, Abdul-Rahman ZH, Lim P, et al. Description of a novel system for grading of endometrial carcinoma and comparison with existing grading systems. Am J Surg Pathol 2005; 29: 295-304.
Kurman RJ, Norris HJ. Evaluation of criteria for distinguishing atypical endometrial hyperplasia from well-differentiated carcinoma. Cancer 1982; 15: 2547-2559.
Yazigi R, Sahid S, Contreras L, Rodriguez T. Carcinoma of the endometrium in patients treated with tibolone. Gynecol Oncol. 2004; 93: 568-70.
Bokhman JV. Two pathogenetic types of endometrial carcinoma . Gynecol Oncol 1983; 15: 10-17.
Silva EG, Tornos CS, Follen-Mitchell M. Malignant neoplasms of the uterine corpus in patients treated for breast carcinoma : the effects of tamoxifen. Int J Gynecol Pathol 1994; 13: 248-258.
Cohen L, Azaria R, Fishman A, et al. Endometrial cancers in postmenopausal breast cancer patients with tamoxifen treatment. Int J Gynecol Pathol 1999; 18: 304-310.
Ismail SM. Pathology of endometrium treated with tamoxifen. J Clin Pathol 1994; 47: 827-833.
Cuo P, Zheng M, Kramer EE, Godwin TA. p53 overexpression and bcl-2 persistence in endometrial carcinoma: comparison of papillary serous and endometrioid subtypes. Gynecol Oncol 1996; 61: 167-174.
Bennett AE, Rathore S, Rhatigan RM. Focal necrotizing endometritis: a clinicopathologic study of 15 cases. Int J Gynecol Pathol 1999; 18: 220-225.
Otazu RD de, Garcia-Nieto L, Izaguirre-Gondra E, Mayayo E, Ciani S, Nogales FF. Endometrial coccidiosis. J Clin Pathol. 2004; 57: 1104-5.
Kleatzeris LD, Bulmer JN, Warren A, et al. Endometrial lymphoid tissue in the timed endometrial biopsy : morphometric and immunohistochemical aspects. Am J Obstet Gynaecol 1992; 167: 6667-6674.