Vol. 37, n.º 4, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 4, 2004 |
Francisco Colina, Guadalupe López Alonso, Carolina Ibarrola
Departamento de Anatomía Patológica. Hospital Universitario 12 de Octubre. Madrid. fcolina.hdoc@salud.madrid.org
RESUMEN
Este protocolo es el resultado de un consenso multidisciplinario entre patólogos, digestólogos, cirujanos y oncólogos de un mismo hospital. Está basado en la revisión de la literatura científica relevante y en la experiencia profesional orientadas a buscar la mayor efectividad en el diagnóstico y la mejor adecuación en la conducta terapéutica de las situaciones preneoplásicas, premalignas y malignas del esófago y de la unión gastroesofágica. Para ello propone unas normas en el uso de la terminología internacional, en el manejo de los distintos especímenes (biopsia endoscópica, resección endoscópica y pieza de resección quirúrgica) y en el esquema diagnóstico a seguir por el patólogo. Su finalidad es que el informe histopatológico ofrezca la información útil, precisa y estandarizada que es necesaria para una comunicación adecuada y clara entre clínicos y patólogos en orden a establecer una uniformidad en los procesos de diagnóstico, de seguimiento (evaluación y control periódico) y de estadificación.
Palabras clave: Esófago de Barrett, metaplasia intestinal, esófago, unión gastroesofágica, unión escamocolumnar, revestimiento esofágico metaplásico, displasia esofágica, adenocarcinoma esofágico, carcinoma escamoso esofágico, carcinoma epidermoide esofágico.
SUMMARY
This protocol is the result of a multidisciplinary consensus among pathologists, digestive physicians, surgeons and oncologists from the same hospital. It is based on a review of relevant scientific literature and on professional experience in order to achieve the greatest effectiveness in diagnosis and appropriateness in the management of preneoplastic, premalignant and malignant conditions of the esophagus and the gastroesophagic junction. Guidelines are proposed in the use of international terminology, proper handling and dissection of various types of specimens (endoscopic biopsy, endoscopic excision and surgical resection) and the surgical pathology report. The aim of the histopathologic report is to offer useful, accurate and standardized information, necessary for an adequate and clear communication among clinicians and pathologists to achieve a uniformity in methodologic approach to diagnosis, follow-up and staging of esophageal neoplasms.
Key words: Barrett’s esophagus, intestinal metaplasia , esophagus , gastroesophagic junction, squamocolumnar junction, esophageal columnar lining, columnar-lined esophagus, esophageal dysplasia, esophageal adenocarcinoma , esophageal squamous carcinoma.
INTRODUCCIÓN
En el Registro de Tumores del Hospital 12 de Octubre constan 31, 28 y 38 carcinomas esofágicos y de la unión gastroesofágica registrados nuevos con fecha de diagnóstico en los años 1999, 2000 y 2001 respectivamente. La endoscopia digestiva alta más biopsia produjo 576 especímenes topografiados como de localización esofágica y de la unión esofagogástrica en 2003. Un porcentaje alto (63%) requiere del patólogo el diagnóstico, la evaluación y el control periódico de situaciones preneoplásicas y premalignas (esófago de Barrett, displasia epitelial).
El esófago de Barrett es la enfermedad preneoplásica condicionada por el reflujo gastroesofágico y su definición y criterios de diagnóstico son problemáticos. El concepto de que el revestimiento escamoso esofágico ha sido sustituido por epitelio cilíndrico y glandular, aunque simple, crea problemas en la práctica por la dificultad de determinar la frontera entre esófago y cardias. La unión esofagogástrica es definida de modo distinto por endoscopistas, radiólogos o patólogos y su localización fisiológica puede variar en varios centímetros según sea el medio diagnóstico empleado. Endoscópicamente el epitelio cilíndrico es fácilmente distinguible por su coloración rojiza y su aspecto aterciopelado del epitelio escamoso pálido y nacarado. Cuando aparece como prolongaciones en «llamarada» o lengüetas continuas desde la mucosa gástrica o como islotes situados altos en la mucosa escamosa se ha denominado esófago de Barrett de segmento largo (más de 3 cm). Tiene mayor dificultad distinguir si el llamado «segmento corto de Barrett» es el esófago distal revestido por epitelio cilíndrico o si el endoscopista ha identificado como tal un cardias gástrico tubular como puede suceder, por ejemplo, en las hernias de hiato. Para soslayar este problema la actitud práctica ha sido denominar esófago de Barrett sólo a la presencia de metaplasia intestinal, cualquiera que sea la extensión de un epitelio cilíndrico en el revestimiento esofágico (1-3). Hacer constar en el diagnóstico histopatológico la presencia o no de metaplasia intestinal es la finalidad de la biopsia, que se convierte así en el método imprescindible del diagnóstico de esófago de Barrett y la que consecuentemente condiciona un seguimiento biópsico periódico que será modulado por el desarrollo o no de displasia glandular, cuyo grado alto es el indicativo de resección (fig. 1). En el algoritmo diseñado por la Subcomisión de Tumores Digestivos del Hospital 12 de Octubre para el seguimiento endoscópico y biópsico en esófago de Barrett se expresa un reconocimiento de la dificultad que supone el identificar la displasia epitelial y en graduarla correctamente. Las implicaciones de un diagnóstico de displasia epitelial recomiendan una absoluta seguridad en su reconocimiento y evitar un componente de subjetividad se ha pretendido conseguir con la colaboración de dos patólogos en el diagnostico de su alto grado.
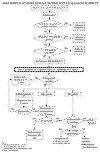
Fig. 1: Algoritmo diseñado por la
Subcomisión de Tumores Digestivos del Hospital 12 de Octubre para el seguimiento
endoscópico y biópsico en esófago de Barrett.
El alto número de asistencias y la necesidad de consenso en nomenclaturas motivó la revisión del protocolo hospitalario del carcinoma de esófago para su puesta al día por la Subcomisión de Tumores Digestivos de este hospital. Como parte de este protocolo el capítulo de Anatomía Patológica, que aquí se expone, está desarrollado para producir la mejor información histopatológica posible en el espécimen analizado, utilizando unas normas de manejo y de uso de nomenclatura uniformes.
El protocolo esta estructurado para que la consulta del mismo sea en función del tipo de espécimen anatómico que la asistencia clínica proporciona al patólogo y a cuyo material tisular deben aplicársele las normas, definiciones y manejo apropiados.
El lector encontrará en cada epígrafe el requerimiento de la mínima información clínica a constatar en la petición de estudio histopatológico, necesaria para conseguir:
los objetivos pretendidos con ese estudio del espécimen considerado.
el manejo histológico en el laboratorio
la evaluación microscópica
los términos que debe utilizar el informe anatomopatológico
el esquema diagnóstico histopatológico aplicable a cada espécimen
las notas pertinentes que son específicas para ese tipo de espécimen.
Su finalidad es ofrecer la información precisa a los clínicos y a los patólogos en orden a una uniformidad del proceso diagnóstico y de la estadificación. Este protocolo es aplicable a los tumores epiteliales malignos (carcinomas) y a las enfermedades premalignas localizadas en esófago y en unión esofagogástrica. Los dos tipos histológicos más frecuentes de malignidad esofágica son el carcinoma epidermoide y el adenocarcinoma. Sus correspondientes lesiones premalignas (displasias epiteliales) son también de dos tipos (displasia epitelial escamosa y displasia epitelial glandular). Es imprescindible su diagnóstico histológico previo al tratamiento oncológico (quirúrgico y/o médico).
1. NORMAS PARA TOPOGRAFÍA
En la literatura se han empleado diferentes parámetros para clasificar los tumores de la unión esofagogástrica como de origen gástrico o esofágico. La OMS (4) establece los siguientes normas para su clasificación topográfica:
Los carcinomas epidermoides localizados en la unión esofagogástrica se consideran carcinomas del esófago distal aunque crucen la unión esofagogástrica.
Los adenocarcinomas que cruzan la unión esofagogástrica afectando al esófago y al estómago se consideran como adenocarcinomas de la unión esofagogástrica, independientemente de dónde esté localizado el mayor volumen de masa tumoral.
Los adenocarcinomas localizados en su totalidad por encima de la unión esofagogástrica se consideran carcinomas esofágicos.
Los adenocarcinomas localizados por completo por debajo de la unión esofagogástrica se consideran de origen gástrico.
2. INFORMACIÓN CLÍNICA NECESARIA PARA EL ESTUDIO HISTOPATOLÓGICO DE CUALQUIER TIPO DE ESPÉCIMEN CON POSIBLE CARCINOMA ESOFÁGICO
Todos los especímenes obtenidos tras el procedimiento quirúrgico o endoscópico apropiados, deberán remitirse al Sevicio de Anatomía Patológica acompañados de una hoja de petición de estudio en la que se hará constar siempre la siguiente información:
Identificación del paciente (nombre y dos apellidos, número de historia y de seguridad social, edad, fecha de nacimiento y sexo).
Médico y Servicio responsables.
Fecha del procedimiento.
Historia relevante: hallazgos relevantes de imagen, endoscópicos o quirúrgicos, carcinoma previo etc.
Diagnóstico clínico.
Procedimiento: diagnóstico, curativo, paliativo.
Técnica de obtención de la muestra: cepillado esofágico, biopsia, resección mucosa endoscópica, resección quirúrgica.
Número de especímenes, cada uno de ellos identificado por su localización anatómica. Según el tipo de muestra se irán detallando en los siguientes apartados los datos clínicos de importancia para la correcta evaluación y correlación clínico-patológica de cada espécimen.
3. DEFINICIONES
Esófago cervical: el comprendido entre el borde inferior del cartílago cricoides y el orificio torácico, aproximadamente 18 cm desde el incisivo superior.
Esófago intratorácico superior: el comprendido entre el orificio torácico y la bifurcación traqueal, aproximadamente 24 cm desde el incisivo superior.
Esófago torácico medio: la mitad proximal del esófago comprendida entre la bifurcación traqueal y la unión esofagogástrica. El nivel inferior está aproximadamente a 32 cm del incisivo superior.
Esófago torácico inferior (incluye esófago abdominal): la mitad distal del esófago comprendida entre la bifurcación traqueal y la unión esofagogástrica. El nivel inferior está aproximadamente a 40 cm del incisivo superior.
Unión esofagogástrica: se define como la región anatómica donde el esófago tubular se une al estómago.
Unión escamo-columnar: unión del epitelio escamoso habitual del esófago con el epitelio columnar (glandular). También se denomina línea Z. Puede coincidir con la unión esofagogástrica o estar localizada por encima de ésta.
Cardias: tradicionalmente los 1-2 cm iniciales tras la línea Z se describen como mucosa glandular similar a la antral y sin las células especializadas de la mucosa fúndica. Hoy existen dudas sobre si este tipo de mucosa es anatómica o es una transformación de la mucosa fúndica en situaciones patológicas (reflujo, Helicobacter..) (5-7).
Esófago de Barrett: esófago con revestimiento mucoso gástrico con cualquier grado de metaplasia intestinal (1-3).
Heterotopia gástrica: áreas de mucosa gástrica ectópica congénita, situadas más frecuentemente en esófago cervical que incluyen epitelio foveolar y células parietales y principales.
Metaplasia intestinal: sustitución del epitelio de tipo gástrico (foveolar, glandular, superficial) por epitelio intestinal que es fácilmente reconocido por la presencia de células caliciformes (8). Puede subdividirse en tres tipos. El tipo I o completa muestra epitelio intestinal que incluye células absortivas, caliciformes y de Paneth. Los tipos II y III son metaplasias incompletas pudiendo entremezclar sólo células caliciformes con epitelio gástrico. La células caliciformes en los tipos I y II producen sialomucinas ácidas (Azul Alcian) mientras que en el tipo III producen sulfomucinas (Diamina) (9).
Neoplasia intraepitelial: lesión del epitelio (escamoso o glandular) caracterizada por cambios morfológicos que incluyen alteraciones arquitecturales y citológicas (displasia) localizados por encima de la membrana basal. Es una lesión premaligna que es capaz de progresar a carcinoma invasivo. La displasia puede ser de células escamosas o glandulares dependiendo del tipo de epitelio del que se origine. En virtud del grado de alteración citológica y arquitectural se clasifica en displasia de bajo grado (displasia leve y moderada) y displasia de alto grado (displasia intensa y carcinoma in situ) (4).
Displasia de células escamosas: Las alteraciones arquitecturales consisten en una desorganización del epitelio y pérdida de la polaridad. Citológicamente existe desproporción núcleo-citoplasma, núcleo irregular e hipercromático y aumento del número de mitosis, que pueden llegar a ser atípicas (10,11).
Displasia de bajo grado (leve y moderada): las alteraciones están limitadas a la mitad inferior del epitelio.
Displasia de alto grado (intensa y carcinoma in situ): las células atípicas ocupan todo el espesor del epitelio, no observándose maduración en la superficie del mismo. La atipia citológica es mayor que en la displasia de bajo grado.
Displasia glandular: Asienta habitualmente sobre esófago de Barrett y por tanto sobre metaplasia intestinal. Las alteraciones arquitecturales consisten en cambios en la configuración de las glándulas con pseudoestratificación y apiñamiento de los núcleos, que pueden llegar a aparecer desorientados respecto a la membrana basal (pérdida de la polaridad). Puede haber patrón papilar o ramificación glandular. Citológicamente existen anomalías en el tamaño de las células epiteliales y desproporción núcleo-citoplasma, con disminución o ausencia de producción de mucina (mayor basofilia citoplasmática). Las dismorfias celulares y arquitectónicas irán aumentando en grado de intensidad según el epitelio vaya adquiriendo un mayor status premaligno, es decir una mayor posibilidad o capacidad de convertirse finalmente en maligno (12,13).
Displasia de bajo grado (leve y moderada): existe disminución de la mucosecreción, pseudoestratificación nuclear limitada a la mitad inferior del epitelio glandular, mitosis ocasionales, leve pleomorfismo y mínimos cambios arquitecturales.
Displasia de alto grado (displasia severa-carcinoma in situ): mayor pleomorfismo y disminución de la mucosecreción, mitosis frecuentes, pseudoestratificación nuclear que se extiende a la porción superior de las células y marcadas alteraciones arquitecturales que incluyen patrón papilar o cribiforme como su máxima expresión, siempre y cuando la membrana basal glandular permanezca intacta.
Indeterminado para displasia: cuando resulta difícil, si no imposible, distinguir la displasia de bajo grado de cambios epiteliales reactivos o regenerativos, especialmente cuando éstos están en relación con erosiones o ulceraciones.
Un patrón de displasia en metaplasia intestinal incompleta asociada con producción de mucina de tipo gástrico muestra núcleos grandes, desorientados y vesiculares o pleomórficos y se describe (4) asociado a adenocarcinoma pobremente diferenciado, si bien en nuestra experiencia no lo hemos reconocido hasta la fecha.
Carcinoma invasivo: neoplasia epitelial maligna que sobrepasa la membrana basal y por tanto tiene capacidad metastásica.
Carcinoma esofágico precoz: término equivalente al utilizado en estómago y que se refiere al adenocarcinoma de esófago y unión esofagogástrica que infiltra sólo mucosa o mucosa y submucosa pero sin afectación de la muscular propia y tenga o no metástasis en la primera estación ganglionar. Se utiliza el término carcinoma esofágico superficial para los carcinomas epidermoides (de células escamosas) de esófago con grado de invasión similar (afectación de mucosa o mucosa y submucosa sin invadir capa muscular propia) tenga o no metástasis en ganglios linfáticos regionales (14-18). Ambos términos se corresponden con T1 en la estadificación TNM.
Carcinoma esofágico avanzado: neoplasia que infiltra más allá de la submucosa, afectando al menos la muscular propia.
Carcinoma epidermoide (convencional) o de células escamosas: se refiere a la forma habitual de la neoplasia maligna del epitelio esofágico escamoso. Además existen tres variantes adicionales (subtipos) de carcinoma epidermoide esofágico:
Carcinoma verrucoso: lesión exofitica que se define histológicamente como un tumor papilar maligno constituido por epitelio escamoso queratinizado con mínima atipia citológica. Se caracteriza por su crecimiento lento y muy frecuentemente es al diagnóstico una enfermedad localizada.
Carcinoma de células fusiformes (carcinosarcoma, carcinoma pseudosarcomatoso) (10): lesión polipoide que se define histológicamente como un carcinoma de células escamosas con un componente variable de células fusocelulares sarcomatosas capaces de formar hueso, cartílago y músculo esquelético o mostrar cambios pleomórficos. Con técnicas de inmunohistoquímica las células sarcomatosas muestran un cierto grado de diferenciación epitelial.
Carcinoma escamoso basaloide: neoplasia maligna constituida por células de escaso citoplasma basófilo y núcleo hipercromático con patrón de crecimiento sólido, estructuras pseudoglandulares y áreas de comedonecrosis (19,20).
Adenocarcinoma (convencional): neoplasia epitelial maligna del esófago con diferenciación glandular asentando principalmente en esófago de Barrett. Infrecuentemente se origina en mucosa gástrica heterotópica o en glándulas esofágicas submucosas. El adenocarcinoma convencional puede ser adicionalmente calificado de: papilar, tubular, mucinoso y de células en anillo de sello (4).
Carcinoma adenoescamoso: aquel que muestra un componente significativo de carcinoma escamoso entremezclado con un adenocarcinoma tubular.
Carcinomas originados en glándulas esofágicas:
Mucoepidermoide.
Carcinoma adenoide quístico.
Carcinoma de célula pequeña (oat cell): Neoplasia de morfología y fenotipo (neuroendocrino) similar al de pulmón.
Carcinoma indiferenciado: neoplasia epitelial maligna sin características de células escamosas, estructuras glandulares u otras características que indiquen diferenciación salvo la epitelial.
Tumor maligno: neoplasia maligna que no ha podido tipificarse con mayor precisión y por tanto puede ser epitelial o mesenquimal. El estudio inmunohistoquímico, contribuye a disminuir el número de diagnósticos de este tipo.
4. ESPECÍMENES ENDOSCÓPICOS
4.1. CEPILLADO ESOFÁGICO
Previamente a la toma de biopsia se puede realizar cepillado. Se deben preparar 6 portas. Cuatro de ellos se deben fijar inmediatamente en alcohol de 96º para una posterior tinción de Papanicolau y 2 se dejarán secar al aire para una tinción de Romanowsky.
4.2. BIOPSIA ENDOSCÓPICA
Información clínica necesaria
El Servicio de Gastroenterología deberá remitir cada toma con su localización anatómica convenientemente nominada en envase aparte y en la petición de informe anatomopatológico. En esta última deberán constar siempre la sospecha diagnóstica clínica, el tamaño de la lesión y la morfología o aspecto endoscópico (cambio de coloración, lesión plana, polipoide, masa vegetante, ulcerada, estenosante, de aspecto infiltrativo, etc.). Los especímenes con propuesta diagnóstica de esófago de Barrett (de los cuatro cuadrantes, cada 2 cm de zona con cambio de coloración de la mucosa), remitidos en envases aparte, deberán ser nominados por procedencia anatómica. Se recomienda un numero de 6 fragmentos para que el material sea representativo de la lesión observada endoscópicamente.
Objetivo
El diagnóstico del tipo de lesión:
Lesión no neoplásica (inflamatoria, esófago de Barrett).
Lesión neoplásica no objeto de este protocolo (tumores mesenquimales, linfoma, tumores neuroendocrinos).
Lesión neoplásica premaligna (escamosa o glandular).
Lesión neoplásica epitelial maligna (carcinoma escamoso o adenocarcinoma).
Manejo histopatológico
La muestras deben remitirse en formol. Cada muestra (fragmentos de un envase) se incluirá en una cápsula diferente.
En la descripción macroscópica se especificará el número de fragmentos de cada muestra indicando la región anatómica donde han sido obtenidas.
Evaluación microscópica
a) -especímenes con propuesta diagnóstica de esófago de Barrett
Tipo de tejido.
Presencia de epitelio de tipo gástrico.
Presencia o no de metaplasia intestinal. Dado que es la demostración de displasia el criterio empleado para condicionar mayor o menor seguimiento endoscópico en la literatura y en la practica de nuestro hospital (ver fig. 1), es prescindible el empleo de tinciones especiales (Azul Alcian, Diamina) para calificar adicionalmente en subtipos la metaplasia intestinal si se reconocen morfológicamente con claridad las células caliciformes.
Presencia de bacilos tipo Helicobacter.
Existencia de neoplasia (intraepitelial-displasia o invasiva).
Existencia de otras lesiones (esofagitis, úlcera).
Esquema de diagnóstico histopatológico
Ej. 1: Biopsias nominadas como procedentes de «lengüeta en llamarada» con epitelio de tipo gástrico con metaplasia intestinal. Presencia de Helicobacter.
Ej. 2: Biopsias nominadas como procedentes de «a 35 cm. de arcada dentaria» con epitelio de tipo escamoso esofágico en continuidad con epitelio de tipo gástrico sin metaplasia intestinal. Presencia de Helicobacter.
Ej. 3: Biopsias nominadas como procedentes de «a 32 cm. de arcada dentaria» con epitelio escamoso de tipo esofágico con esofagitis aguda moderada.
Ej. 4: Biopsias nominadas como procedentes de «estenosis a 29 cm de arcada dentaria» con epitelio de tipo escamoso esofágico y de tipo gástrico con cambios de fondo y borde de úlcera. Presencia de Helicobacter. No se observan signos de malignidad.
Ej. 5: Biopsias nominadas como procedentes de «estenosis a 30 cm. de arcada dentaria» epitelio de tipo escamoso esofágico en continuidad con epitelio de tipo gástrico con metaplasia intestinal y displasia de alto grado.
Ej. 6: Biopsias nominadas como procedentes «lesión sobrelevada a 28 cm. de arcada dentaria» con adenocarcinoma.
b) -especímenes con propuesta diagnóstica de
carcinomaTipo de tejido.
Existencia de tumor.
Tipo histológico:
– Epidermoide.
– Adenocarcinoma.
– Carcinoma de célula pequeña (oat cell).
– Carcinoma Sine Alter Inscriptio (SAI).
Grado de infiltración (neoplasia intraepitelial o invasiva).
Lesiones asociadas.
Comentarios:
– Correlación con la información clínica, cuando sea necesario
– Correlación con otros especímenes, cuando sea necesario.
Esquema de diagnóstico histopatológico
Ej. 1: Biopsia de mucosa esofágica con carcinoma epidermoide.
Ej. 2: Biopsia de mucosa esofágica con cambios de borde y fondo de úlcera sin evidencia de signos histológicos de malignidad en los cortes seriados.
c) especímenes para control de anastomosis
En las biopsias endoscópicas de seguimiento se emitirán los mismos posibles diagnósticos que en las otras biopsias de estudio pretratamiento.
5. -ESPECÍMENES DE RESECCIÓN ENDOSCÓPICA
En aquellos casos en que esté indicada la resección endoscópica, sea con intención curativa o paliativa (14-16,18).
Información clínica
Se remitirá la pieza en fresco avisando al patólogo. Deberá informarse si el proceder es curativo o paliativo.
Objetivo
El protocolo que debe aplicarse es el mismo que para las piezas convencionales, teniendo en cuenta que la pieza no incluirá todo el espesor de la pared esofágica y que con estas piezas no se remiten ganglios.
Examen macroscópico
a) Teñir con tinta china los bordes de resección mucosos y la parte profunda (margen radial) de la pieza.
b) Colocar la pieza orientada en una superficie plana (corcho o cartón) y prenderla a ésta (con agujas) para su correcta fijación en formol.
c) Una vez fijada en formol, realizar secciones finas paralelas perpendiculares al margen radial hasta la inclusión total de la pieza.
Evaluación microscópica
1) Tipo de tejido
2) Tumor
a) Tipo histológico
b) Grado histológico
c) Profundidad de invasión
3) Otras lesiones
4) Bordes quirúrgicos circunferencial y radial.
Esquema de diagnóstico histopatológico
Ej. 1: Pieza de resección endoscópica de mucosa esofágica con carcinoma epidermoide bien diferenciado limitado a mucosa (carcinoma esofágico superficial). Límites quirúrgicos circunferenciales libres de neoplasia. Margen de resección radial (submucosa) libre de neoplasia.
Ej. 2: Pieza de resección endoscópica de mucosa esofágica con adenocarcinoma bien diferenciado que infiltra submucosa afectando al margen de resección radial (submucosa). Bordes quirúrgicos circunferenciales libres de neoplasia.
6. -ESPECÍMENES DE RESECCIÓN QUIRÚRGICA
Información clínica necesaria
Los Servicios Quirúrgicos informarán en la petición de informe anatomopatológico del tipo de intervención practicada (resecciones segmentarias o totales) y si el proceder quirúrgico tiene objetivo curativo o paliativo. En el caso de proceder paliativo que no exija resección de la neoplasia, remitirán muestra tisular para tipar morfológicamente el tumor en orden a una posterior terapéutica oncológica.
Objetivo
El estudio histopatológico valorará el tipo histológico de la neoplasia, el grado de diferenciación, la topografía, la estadificación (p-TNM) y el estado de los límites quirúrgicos (proximal, distal y radial). Se compondrá de:
Examen macroscópico
A) Pieza de resección:
Tipo de espécimen (esofagectomía total o parcial, esofagogastrectomía, etc.).
Fijado/en fresco.
Número de piezas remitidas.
Dimensiones.
Diagnóstico intraoperatorio previo (si lo hubiera).
B) Tumor:
Localización: definir claramente la situación del tumor respecto de la unión esofagogástrica.
Tipo macroscópico:
— carcinoma esofágico superficial: polipoide, en placa, deprimido, oculto (21)
— carcinoma esofágico avanzado (clasificación de Ming ) (22): exofítico, ulcerado, infiltrante.
Descripción (color, consistencia, perforación).
Tamaño tumoral:
— diámetro máximo en superficie. Ej.: «5 cm x 4 cm».
— porcentaje del perímetro de la circunferencia esofágica que ocupa.
— grosor máximo (desde la superficie luminal al punto de mayor profundidad de infiltración macroscópica).
Infiltración en profundidad: mucosa o submucosa, muscular propia, adventicia, otros órganos o estructuras.
Distancia al borde de resección quirúrgico proximal, distal y radial (margen quirúrgico de la adventicia más próximo al tumor)
C) Lesiones en esófago no tumoral.
Muestreo sistemático
a) Al menos cinco cortes del tumor (interfase con esófago no tumoral, puntos de máxima penetración y de su relación con el margen radial, que se pintará con tinta china)
b) Bordes quirúrgicos proximal y distal.
c) Otras lesiones.
d) Todos los ganglios linfáticos de la grasa perivisceral.
Evaluación microscópica
Tipo histológico del tumor: siguiendo la clasificación de la OMS (ver ANEXO 1).
Grado de diferenciación histológica (cuando un carcinoma tenga una diferenciación heterogénea, el grado será el del componente menos diferenciado):
— Carcinoma epidermoide (de células escamosas):
Bien diferenciado: alta proporción de células escamosas grandes y diferenciadas, similares a queratinocitos y una baja proporción de células pequeñas de tipo basal localizadas en la periferia de los nidos tumorales. La presencia de queratinización se ha considerado como un signo de diferenciación, aunque el epitelio escamoso esofágico normal no queratiniza.
Moderadamente diferenciado: es el más frecuente (2/3 de todos los carcinomas de células escamosas). No existen criterios universalmente aceptados para su gradación.
Pobremente diferenciado: constituido fundamentalmente por células de tipo basal con elevada actividad mitótica.
Un posible subtipo de interés pronóstico (verrucoso o fusocelular).
— Adenocarcinoma:
Bien diferenciado: más del 95% del tumor forma glándulas.
Moderadamente diferenciado: entre un 50-95% del tumor forma glándulas.
Pobremente diferenciado: menos del 50% del tumor forma glándulas
— Carcinoma de células pequeñas (oat cell)
— Carcinoma indiferenciado: ausencia de signos histológicos de diferenciación otra que la meramente epitelial.
Topografía: decidida según 1 - tipo histológico y 2 - situación macroscópica (ver normas para topografiar en la introducción).
Extensión al estómago.
Invasión de venas y vasos linfáticos.
Estadio (extensión de la enfermedad: localizada, regional, diseminada):
— Nivel profundo de infiltración (capa): carcinoma in situ, en lámina propia, en submucosa, en muscular propia, en adventicia.
— Presencia de metástasis ganglionares o de invasión de estructuras adyacentes (enfermedad regional).
— Metástasis a distancia (enfermedad diseminada).
Se utilizará la clasificación p-TNM (ver ANEXO 2 y nota). El patólogo realizará una estadificación con los datos de los que dispone. El clínico podrá modificarla con el conjunto global de datos del paciente (c-TNM).
Otras lesiones. Ej.: esófago de Barrett, displasia...
Comentarios (cuando sea necesario):
— Correlación con otros especímenes.
— Correlación con diagnóstico intraoperatorio.
— Correlación con los datos clínicos.
Esquema de diagnóstico histopatológico (incluye topografía)
Ej. 1: Pieza de esofagectomía total con carcinoma epidermoide esofágico, bien diferenciado, que infiltra la capa muscular propia sin llegar a la adventicia. Sin evidencia de metástasis en los 10 ganglios linfáticos aislados. Bordes quirúrgicos libres de neoplasia. p-T2N0Mx.
Ej. 2: Pieza de esofagectomía total con carcinoma epidermoide esofágico, moderadamente diferenciado, que infiltra la adventicia sin llegar al margen radial. Metastatiza en 5 de los 7 ganglios linfáticos aislados. Bordes quirúrgicos proximal y distal libres de neoplasia. p-T3N1Mx.
Ej. 3: Pieza de esofagectomía distal y gastrectomía polar superior con adenocarcinoma de esófago que infiltra submucosa respetando la capa muscular propia (adenocarcinoma esofágico precoz) sin evidencia de metástasis en 10 ganglios linfáticos aislados. Bordes quirúrgicos proximal y distal así como margen radial libres de neoplasia. p-T1N0 Mx.
Nota pertinente sobre estadificación
En el caso de los adenocarcinomas de la unión gastroesofágica se realizará el p-TNM esofágico o gástrico dependiendo de donde este localizada la máxima infiltración tumoral. En los casos donde la afectación esofágica este limitada al esófago abdominal se realizara el p-TNM gástrico ya que este segmento del esófago esta recubierto por serosa. En caso de duda se realizará el p-TNM que rinda una T mayor. En el informe se especificará el p-TNM realizado (ver ANEXO 2).
Ej.: Pieza de esofagectomía distal y gastrectomía polar superior con adenocarcinoma de la unión gastroesofágica que infiltra submucosa esofágica y capa muscular propia gástrica. Metastatiza en 5 de 8 ganglios linfáticos aislados. Bordes quirúrgicos proximal y distal así como margen radial libres de neoplasia. p-T2aN1Mx (p-TNM gástrico).
7. PIEZAS (biopsias y resecciones quirúrgicas) EN LAS QUE ESTÁ INDICADA LA RADIOTERAPIA PREOPERATORIA
El tratamiento preoperatorio con quimiorradioterapia puede reducir el tamaño del tumor esofágico antes de una posterior exéresis quirúrgica.
Información clínica necesaria
a) Biopsia pre-radioterapia
Los servicios quirúrgicos o médicos informarán en la petición de informe anatomopatológico de que se trata de un paciente candidato a tratamiento con radioterapia preoperatoria.
Será exigible la biopsia con un diagnóstico confirmatorio de carcinoma esofágico antes de proceder al tratamiento de radioterapia.
b) Pieza de resección post-radioterapia
Los servicios quirúrgicos informarán en la petición de informe anatomopatológico si el proceder quirúrgico tiene objetivo curativo o paliativo, la localización del tumor y el estadio c-TNM pre-radioterapia.
Objetivo
El objetivo y el protocolo son los mismos que los de la biopsia y pieza de resección convencional.
El nido tumoral más profundo determinará el nivel profundo de invasión en la estadificación p-TNM (ANEXO 2).
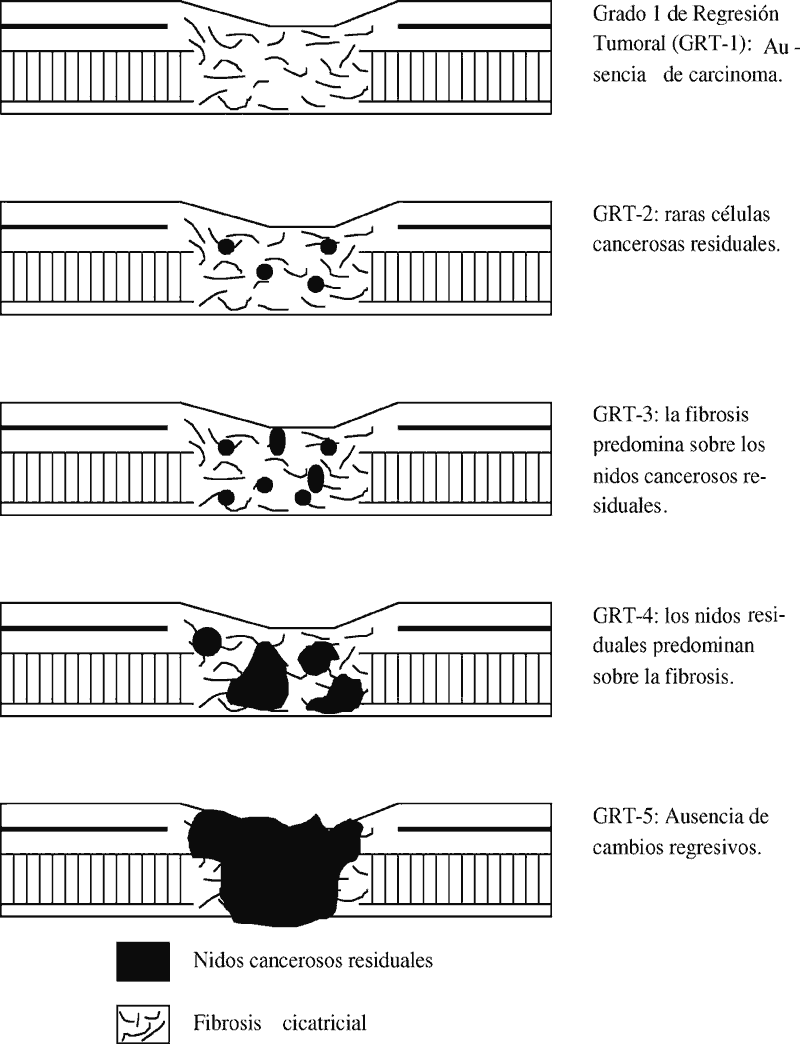
Se indicará en el apartado de observaciones el grado de regresión tumoral siguiendo el método de Mandard et al.(23) (ANEXO 4) para los carcinomas epidermoides esofágicos post-radioterapia.
Manejo histopatológico
Descripción macroscópica
Se seguirá el mismo esquema que el seguido en las piezas de resección convencional (ver apartado 4).
Muestreo sistemático
a) Teñir con tinta china la parte externa (margen radial) de la pieza.
b) Tras fijación, mapeo de la zona tumoral. En los casos en los que no se identifique el tumor o en los que sus límites con respecto al margen radial no sean claros, puede ser necesaria la inclusión completa de toda la zona sospechosa para estudio histológico.
Esquema de diagnóstico histopatológico
Ej.: Pieza de esofagectomía total post-radioterapia con carcinoma epidermoide esofágico bien diferenciado que infiltra la capa muscular propia sin llegar a la adventicia. Sin evidencia de metástasis en 13 ganglios linfáticos aislados. Bordes quirúrgicos libres de neoplasia. Cambio fibroso post-radioterapia moderado (grado de regresión tumoral 3). p-T2N0MX.
Ej.: Pieza de esofagectomía post-radioterapia con ausencia de carcinoma residual. Sin evidencia de metástasis en 7 ganglios linfáticos aislados. Cambio fibroso post-radioterapia intenso (grado de regresión tumoral 1). p-T0N0MX.
Nota pertinente
Debido a los efectos de la radioterapia puede existir dificultad en encontrar microscópicamente el carcinoma esofágico e incluso no encontrarlo, así como en la evaluación del grado de diferenciación histológica.
BIBLIOGRAFÍA
Reid, BJ, Weinstein WM. Barrett’s esophagus and adenocarcinoma. Annu Rev Med 1987; 38: 477-92.
Spechler JS, Goyal RK. The columnar-lined esophagus, intestinal metaplasia and Norman Barrett. Gastroenterology 1996; 110: 614-21.
Alikhan M, Rex D, Khan A, et al. Variable pathologic interpretation of columnar lined esophagus by general pathologists in community practice. Gastrointest Endosc 1999; 50: 23-6.
Hamilton SR, Aaltonen LA. WHO Classification: Tumours of the Digestive System. 1st and 2nd chapters. Lyon: IARC Press; 2000.
Chandrasoma PT, Der R, Ma Y, et al. Histology of the gastroesophageal junction. Am J Surg Pathol 2000; 24: 402-9.
Kilgore SP, Ormsby AH, Gramlich TL, et al. The gastric cardia: fact o fiction? Am J Gastroenterol 2000; 93: 921-4.
Sarbia M, Donner A, Gabert HE. Histopathology of the gastroesophageal junction. Am J Surg Pathol 2002; 26: 1207-12.
Antonioli, DA. Gastric carcinoma and its precursors. In: Gastrointestinal Pathology, Goldman, H, Appelman, HD, Kaufman N (Eds), United States and Canadian Academy of Pathology Monograph in Pathology No. 31. Baltimore: Williams Wilkins; 1990. p. 144.
Filipe MI, Munoz N, Matko I, et al. Intestinal metaplasia types and the risk of gastric cancer: A cohort study in Slovenia. Int J Cancer 1994; 57: 324-9.
Mandard AM, Marnay J, Gignoux M, et al. Cancer of the esophagus and associated lesions: detailed pathologic study of 100 esophagectomy specimens. Hum Pathol 1984; 15: 660-9.
Levin KJ, Appelman HD. Atlas of Tumor Pathology. Tumors of the esophagus and stomach. Washington DC: AFIP; 1996.
Riddel RH, Goldman H, Ransohoff DF, et al. Dysplasia in inflammatory bowel disease: standarized classification with provisional clinical applications. Hum Pathol 1983; 14: 931-68.
Antonioli DA, Wang HH. Morphology of Barrett´s esophagus and Barrett´s-associated dysplasia and adenocarcinoma. Gastroenterol Clin North Am 1997; 26: 495-506.
Bogomoletz WV, Molas G, Gayet B, Pottet F. Superficial squamous cell carcinoma of the esophagus. A report of 76 cases and review of the literature. Am J Surg Pathol 1989; 13: 535-46.
Sandick JW, Lanschot JJ, Kate FJ, et al. Pathology of early invasive adenocarcinoma of the esophagus or esophagogastric junction. Cancer 2000; 88: 2429-37.
Tajima W, Nakanhisi Y, Ochiai A, et al. Histopathologic findings predicting lymph node metastasis and prognosis of patients with superficial esophageal carcinoma. Cancer 2000; 88: 1285-93.
Goseki N, Koike M, Yoshida M. Histopathologic characteristics of early stage esophageal carcinoma. A comparative study with gastric carcinoma. Cancer 1992; 69: 1088-93.
Araki K, Ohno S, Egashira A. Pathologic features of superficial esophageal squamous cell carcinoma with lymph node and distal metastasis. Cancer 2002; 94: 570-5.
Banks ER, Frierson HF, Mills SE, et al. Basaloid squamous cell carcinoma of the nead and neck. A clinicopathologic and immunohistochemical study of 40 cases. Am J Surg Pathol 1992; 16: 939-46.
Tsang WY, Chang JK, Lee KC, et al. Basaloid-squamous carcinoma of the upper aerodigestive tract and so-called adenoid cystic carcinoma of the esophagus: the same tumour type? Histopahology 1991; 19: 35-46.
Yoshinaka H, Shimazu H, Fukumoto T, Baba M. Superficial esophageal carcinoma: A clinicopathological review of 59 cases. Am J Gastroenterol 1991; 86: 1413-8.
Ming SC. Atlas of Tumor Pathology. Tumors of the esophagus and stomach. 2nd ed. Washington DC: AFIP; 1973.
Mandard AM, Dalibard F, Mandard JC, et al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer 2000; 73: 2680-6.
ANEXO 1
CLASIFICACIÓN HISTOLÓGICA DE LA OMS DE LOS TIPOS DE CARCINOMAS ESOFÁGICOS
Carcinoma de células escamosas (epidermoide)
Carcinoma verrucoso
Carcinoma de células escamosas basaloide
Adenocarcinoma
Carcinoma adenoescamoso
Carcinoma mucoepidermoide
Carcinoma adenoide quístico
Carcinoma indiferenciado de célula pequeña
Carcinoma indiferenciado
Otros
ANEXO 2
ESTADIFICACIÓN p-TNM DE LOS CARCINOMAS ESOFÁGICOS Y DE LA UNIÓN ESOFAGOGÁSTRICA
CUYO NIVEL MÁXIMO DE INFILTRACIÓN SE
p-T. Tumor primario
TX No es posible valorar el tumor primario
T0 No hay evidencia de tumor primario
Tis Carcinoma in situ
T1 El tumor invade lámina propia o submucosa
T2 El tumor invade muscular propia
T3 El tumor invade adventicia
T4 El tumor invade estructuras adyacentes
p-N. Ganglios linfáticos regionales
NX -Los ganglios no pueden ser valorados
N0 -Ausencia de metástasis ganglionares regionales
N1 -Metástasis en ganglios linfáticos regionales
• -El examen histológico de una linfadenectomía mediastínica habitualmente debe incluir 6 o más ganglios linfáticos. Si son negativos, aunque se aíslen menos de 6 ganglios linfáticos, se clasifica como pN0.
• -Los ganglios linfáticos regionales corresponden a los ganglios linfáticos cervicales (incluyendo los supraclaviculares) para el esófago cervical y los ganglios mediastínicos y perigástricos (excluyendo los celíacos) para el esófago intratorácico.
p-M. Metástasis a distancia
MX -Las metástasis a distancia no pueden ser valoradas
M0 -Ausencia de metástasis a distancia
M1 -Metástasis a distancia
— Para tumores del esófago torácico inferior
M1a -Metástasis en ganglios linfáticos celíacos
M1b -Otras metástasis a distancia
— Para tumores del esófago torácico superior
M1a -Metástasis en ganglios linfáticos cervicales
M1b -Otras metástasis a distancia
— Para tumores del esófago torácico medio
M1a No aplicable
M1b -Ganglios linfáticos no regionales u otras metástasis a distancia
ANEXO 3
ESTADIFICACIÓN p-TNM DE LOS ADENOCARCINOMAS DE UNIÓN ESOFAGOGÁSTRICA CUYO NIVEL
MÁXIMO DE INFILTRACIÓN SE LOCALIZA EN LA
p-T. Tumor primario
TX No es posible valorar el tumor primario.
T0 No hay evidencia de tumor primario.
Tis Carcinoma in situ.
T1 El tumor invade lámina propia o submucosa.
T2 El tumor invade muscular propia o subserosa.
T2a Tumor invade muscular propia.
T2b Tumor invade subserosa.
T3 -El tumor invade serosa (peritoneo visceral) sin invasión de estructuras adyacentes.
T4 El tumor invade estructuras adyacentes.
p-N. Ganglios linfáticos regionales
NX Los ganglios no pueden ser valorados.
N0 -Ausencia de metástasis ganglionares regionales.
N1 -Metástasis de 1 a 6 ganglios linfáticos regionales.
N2 -Metástasis de 7 a 15 ganglios linfáticos regionales.
N3 -Metástasis en más de 15 ganglios linfáticos regionales.
Nota pertinente
El examen histológico de una linfadenectomía regional habitualmente incluye 15 o más ganglios linfáticos. Aunque no se haya encontrado este número, si los ganglios son negativos se clasifica como p-N0.
p-M. Metástasis a distancia
MX -Las metástasis a distancia no pueden ser valoradas.
M0 Ausencia de metástasis a distancia.
M1 Metástasis a distancia.
ANEXO 4
GRADO DE REGRESIÓN TUMORAL EN