
Vol. 42, n.º 1, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 1, 2009 |
CASUÍSTICA
Francisco Manuel Ramos Pleguezuelos, Francisco Javier Velasco Albendea, María del Mar Berenguel Ibáñez, Miguel Lorenzo Campos1, Carlos Vidal Puga
Servicio de Anatomía Patológica. Complejo
Hospitalario Torrecárdenas, Almería.
1 Servicio de Cirugía General.
franpleguezuelos@gmail.com
RESUMEN
El carcinoma histiocitoide de mama es una variante rara de cáncer mamario cuya existencia como entidad distinta de otros tipos ha sido muy debatida, siendo un frecuente problema diagnóstico debido a la similitud histológica con otros tipos de cáncer mamario, así como al escaso número de casos publicados. Es considerado por algunos autores como una variante de carcinoma lobulillar infiltrante y suele confundirse fácilmente con condiciones benignas, u otros tumores mamarios compuestos por células de citoplasma eosinofílico granular o espumoso y núcleo excéntrico. Con objeto de estudiar su incidencia en nuestro medio se han revisado 925 carcinomas de mama existentes en nuestro hospital desde 1996, encontrándose sólo 7 casos diagnosticados como carcinoma histiocitoide, 5 de los cuales se han reubicado como carcinomas lobulillares pleomórficos con cambios apocrinos, quedando solo 2 casos que cumplan todos los criterios histológicos, y citológicos del carcinoma histiocitoide.
Palabras clave: Mama, carcinoma apocrino, células espumosas, mioblastomatoide, histiocitoide.
SUMMARY
Histiocytoid carcinoma of the breast is a rare variant of breast cancer, discussed as different subtype from other breast lesions, being a frequent diagnostic problem due to its hystologic similarity with other types of breast cancer, and because of the few number of cases in literature. Histiocytoid carcinoma is considered by some authors as a subtype of lobular infiltrating carcinoma, easily confused with benign conditions or other mammary lesions composed of cells with a pink granular to foamy cytoplasm and eccentric nucleus. We have reviewed 925 cases from our hospital files since 1996, in order to study the incidence in our area, finding 7 cases diagnosed as histiocytoid carcinoma, 5 of them have been re-classified as pleomorphic lobular carcinoma with apocrine changes, and only two cases were classified as histiocytoid carcinoma upon histological, cytological and immunochemical criteria.
Keywords: Breast, apocrine carcinoma, foam cells, myoblastomatoid, histiocytoid.
INTRODUCCIÓN
Describimos 2 casos de carcinoma mamario con un patrón histológico infrecuente denominado histiocitoide, que recuerda al carcinoma rico en lípidos (1,2) y que posee rasgos citológicos mioblastomatoides (3). El carcinoma histiocitoide de mama se caracteriza citológicamente por tener un bajo grado nuclear, y por la presencia de cambios apocrinos y, al menos focalmente, luces intracitoplasmáticas. Los criterios histológicos más identificativos de esta lesión son la infiltración en fila india y el patrón en diana con fibrosis hialina central, mientras que la inmunohistoquímica expresa GCDFP-15 y citoqueratinas.
La clasificación de la OMS hace referencia al carcinoma histiocitoide a la hora de realizar el diagnóstico diferencial con el carcinoma de células claras rico en glucógeno y como variante del carcinoma lobulillar pleomórfico con diferenciación histiocitoide (4), pero no le otorga entidad propia dentro de dicha clasificación debido probablemente a que es más apropiado considerarlo como un patrón morfológico que puede darse en carcinomas ductales, lobulillares y apocrinos. Sin embargo, varios autores han intentado clasificar al carcinoma histiocitoide como un subtipo especifico.
MATERIAL Y MÉTODOS
Se estudian dos piezas quirúrgicas de mastectomía con vaciamiento axilar, de dos mujeres de 45 y 69 años respectivamente, de mama izquierda en ambos casos, presentando una de ellas una tumoración de 2,2 cm, de coloración grisácea y consistencia elástica, mientras que la otra presenta una zona indurada más difusa, de 2,8 cm, donde se mezcla el tejido de aspecto adiposo y un tejido grisáceo de consistencia firme. Se realizan cortes histológicos de ambos tumores que se incluyen en parafina y se tiñen con batería de hematoxilina-eosina. Se realizan técnicas histoquímicas sobre material parafinado de PAS, PAS-Diastasa, Azul-Alcián; y técnicas inmunohistoquímicas mediante el inmunoteñidor automático Techmate 500, con el kit de detección Chemmate Detection Kit, Peroxidase/DAB (K5001 DAKO) tras desenmascaramiento antigénico por calor en olla a presión en tampón Citrato 10 mM pH 6.0 durante 2 minutos, para receptores de estrógenos (clon 1D5 Dako, prediluido) y progesterona (clon PgR 636 Dako, prediluido), proteína p53 (clon DO-7 Dako, prediluido), proteína p63 (clon 4A4 Dako, prediluido), Ki-67 (clon MIB-1 Dako, prediluido), E-Cadherina (clon NCH-38 Dako, prediluido), CD-68 (clon KP1 Dako, prediluido), GCDFP-15 (clon 23A3 Novocastra, prediluido), Her-2/neu (Dako, prediluido), citoqueratina 7 (clon OV-TL 12/30 Dako, prediluido), citoqueratina 20 (clon Ks20.8 Dako, prediluido), citoqueratina 5-6 (clon D5/16B4 Dako, prediluido), citoqueratina 14 (clon LL002 Novocastra, prediluido), citoqueratina 8/18 (clon 5D3 Novocastra, prediluido), actina músculo específica (clon HF35 Dako, prediluido) y CD-31 (clon JC70A Dako, prediluido) para estudiar la vascularización, además de otras como la S-100 (clon S-100 Dako, 1/10) para descartar el tumor de células granulares, y otras patologías incongruentes en la mama (alfa-fetoproteína [Dako, prediluido] y desmina [clon D33 Dako, prediluido]).
RESULTADOS
Se trata de dos tumores malignos de mama, constituidos por células de abundante citoplasma, que varía desde una coloración anfófila hasta una patente eosinofilia, con bordes celulares poco pronunciados (fig. 1), y presencia de luces o vacuolas intracitoplasmáticas que se tiñen ligeramente con Azul-Alcián. El PAS-Diastasa tiñe la mucina intracitoplasmática de modo granular. Las características nucleares son de bajo grado, con tamaño uniforme, nucléolo muy pequeño, y menos de 1 mitosis por 10 campos de gran aumento. El patrón histológico de invasión es el característico del carcinoma lobulillar con disposición concéntrica en diana y disposición ocasionalmente en fila india, infiltrando la grasa por células individualizadas (fig. 2). En el centro de la lesión y alrededor de las células neoplásicas se advierte un estroma de fibrosis hialina con escasa respuesta inflamatoria. Los hallazgos histológicos recuerdan en cierta forma al carcinoma de células acinares de la parótida, a una proliferación fibroxantomatosa e incluso pueden hacer pensar en un mioblastoma de células granulares. En ninguno de los dos casos se ha podido comprobar la existencia de componente in situ lobulillar o ductal asociado. En el vaciamiento axilar se identifican metástasis ganglionares con patrón sinusoidal, semejante al de los carcinomas lobulillares en uno de los casos, y metástasis masivas en el otro caso, con rotura de cápsula e infiltración de la grasa axilar.
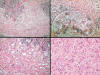
Fig. 1:
El bajo grado histológico y la infiltración
difusa del carcinoma histiocitoide puede plantear el diagnóstico diferencial con
una lesión inflamatoria de tipo histiocítico. Son típicas la infiltración tipo
lobulillar alrededor de ductos, el citoplasma granular y ocasionalmente
vacuolado, así como el bajo grado nuclear y la baja tasa mitótica.

Fig. 2:
El patrón de infiltración concéntrica alrededor
de un ducto se ha denominado patrón en diana o «targetoide». La expresión de
citoqueratina 34-beta-E-12 es errática, pudiendo encontrar tanto casos negativos
como positivos, como en el ejemplo que presentamos. La técnica de PAS tiñe de
forma débil y granular el citoplasma, sirviendo así para diferenciar al
carcinoma histiocitoide del carcinoma de células claras en el que el citoplasma
se tiñe de forma intensa por su alto contenido en glucógeno.
INMUNOHISTOQUÍMICA
Se obtuvo positividad para GCDFP-15, Citoqueratinas 7/8 y 8/18, y de E-cadherina con patrón de membrana. Fueron negativas las técnicas de receptores de estrógenos y progesterona, actina, proteínas p53 y p63, citoqueratinas 5/6, 14 y 20. La negatividad de la proteína S-100 descartó un tumor de células granulares.
El resultado del Herceptest fue positivo con una puntuación de 3 (fig. 3).
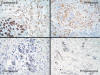
Fig. 3:
Se obtuvo positividad de membrana para
Cadherina-E y para Herceptest con una puntuación 3. Los receptores de estrógenos
y progesterona fueron negativos en las células tumorales, con control interno
positivo de los ductos normales conservados.
Fueron también negativas la desmina y la alfa-fetoproteína, que se incluyeron en la batería realizada para comprobar la congruencia de los resultados.
De esta forma los tumores descritos corresponderían a un carcinoma ductal, por presentar positividad de E-cadherina con patrón de membrana, siendo llamativa la expresión positiva de citoqueratinas 7/8 y 8/18 y negativa de proteína p63 y citoqueratina 14, al igual que ocurre los de subtipo luminal, si bien la negatividad de los receptores de estrógenos y progesterona no permiten clasificarlos como tales.
DISCUSIÓN
El carcinoma histiocitoide o mioblastomatoide ha sido un cajón de sastre donde se incluyen carcinomas lobulillares, ductales o mixtos con diferenciación apocrina. Se describió inicialmente en 1973 por Hood et al. como un tumor metastatizante en párpado, compuesto por células que recuerdan a histiocitos, con núcleo pequeño (de aspecto «inactivo») y abundantes vacuolas citoplasmáticas, que se tiñen con el mucicarmin de Mayer y son negativas para tinción de grasas (5). Posteriormente, en 1979, Azopardi et al. intentan establecer un origen lobulillar, y más tarde se demuestra su diferenciación apocrina (Eusebi et al. 1984). En 1989 Walford apunta a que pueda tratarse de una variante apocrina del carcinoma lobulillar. El término Carcinoma Invasivo Mioblastomatoide es propuesto en 1995 por Eusebi, como el más apropiado para este tipo de tumores, y afirma que no todos son de origen lobulillar, lo cual se ve apoyado por la serie de 11 casos publicada por Gupta en 2002 (2), que observó que la E-Cadherina puede expresarse o no. Los criterios morfológicos son definidos en 2007 por Kempson y publicados por la Escuela de Medicina de la Universidad de Stanford en su página web (6). Estos quedan definidos de la siguiente forma: un bajo grado nuclear (Grado I), es decir, un núcleo pequeño y uniforme, con nucleolo pequeño si está presente, y mitosis infrecuentes (1-2/10 c.g.a.); citoplasma finamente vacuolado, que puede ser tanto anfófilo como eosinófilo, y ligeramente granular como puede verse con el PAS-Diastasa; y bordes celulares no bien definidos. Es necesaria la demostración de diferenciación apocrina, para lo cual puede utilizarse la tinción inmunohistoquímica de GCDFP-15 o técnicas de hibridación in situ. En algunos casos pueden verse luces intracitoplasmáticas que a veces ofrecen una imagen de célula en anillo de sello, y que se ponen de relieve con tinciones de azul-alcián, PAS-Diastasa, o antígeno de membrana epitelial. El patrón de infiltración que adopta este tipo de tumores suele ser concéntrico («en diana» o «targetoide») o en fila india, siendo frecuente ver infiltración grasa por células no cohesivas y fibrosis hialina central.
Existen varios subtipos de carcinoma lobulillar, cuyos rasgos citomorfológicos difieren del carcinoma lobulillar clásico. Sin embargo, estos elementos característicos de cada subtipo no están suficientemente estudiados (7), por lo que son frecuentes los problemas que surgen a la hora del diagnóstico debido a la similitud con otros cánceres de mama, incluido el histiocitoide, y con lesiones benignas (8).
Pueden distinguirse tres subgrupos de carcinoma con rasgos histiocitoides:
Grupo 1: probablemente el más frecuente, constituido por la variante apocrina (o variante sólida) del carcinoma lobulillar clásico no pleomórfico (9), y del que no figura ningún caso en nuestra casuística.
Grupo 2: el carcinoma ductal infiltrante apocrino (o mioblastomatoide constituido por células apocrinas tipo A de la OMS), al que corresponden los 2 casos que ilustramos. Estos casos son reconocidos por la OMS como un subtipo de los carcinomas apocrinos.
Grupo 3: los carcinomas lobulillares pleomórficos con diferenciación apocrina que comparten rasgos morfológicos con los anteriores, pero que a diferencia de ellos, estos presentan un alto grado nuclear (Grado II o III), presentan la particularidad de no expresar receptores estrogénicos, tener un pronóstico significativamente peor que el tipo clásico y ser frecuentemente aneuploides (10). La OMS recoge estos tumores entre las variantes del carcinoma lobulillar, citando a Walford (11), que presentan diferenciación apocrina o histiocitoide (4) (fig. 4). A este grupo corresponden los 5 casos que hemos reubicado y que en un principio fueron diagnosticados como carcinomas histiocitoides.
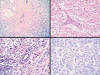
Fig. 4:
Los carcinomas lobulillares pleomórficos con
diferenciación apocrina poseen rasgos histiocitoides, aunque se diferencian del
carcinoma mioblastomatoide por su alto grado histológico. La figura ilustra el
patrón de infiltración en diana y fila india, así como el gran tamaño nuclear
con nucléolos prominentes.
Al igual que otros autores (12) pensamos que el carcinoma histiocitoide define el espectro de un grupo de tumores que pueden unificarse con el nombre de carcinoma invasivo mioblastomatoide (histiocitoide), y que éste puede ser el nombre más apropiado que englobe estas variantes de carcinoma apocrino, ya sea ductales o lobulillares.
Las técnicas histoquímicas pueden ser de utilidad a la hora de realizar el diagnóstico diferencial con el carcinoma rico en lípidos, que expresa positividad para las tinciones de lípidos (Sudán), y negatividad de las tinciones de mucina (Azul Alcián), de manera opuesta a lo que ocurre en el carcinoma histiocitoide. La técnica de PAS ofrece una positividad granular en el carcinoma histiocitoide, mientras que en el carcinoma de células claras rico en glucógeno pone de manifiesto un citoplasma claro y con abundante glucógeno (5). La positividad para GCDFP-15 pone de manifiesto la diferenciación apocrina del tumor.
Las lesiones benignas que mayor similitud pueden presentar con el carcinoma histiocitoide, suelen ser las infiltraciones histiocíticas secundarias a necrosis grasa o procesos inflamatorios, cuyo diagnóstico se basará en la inmunohistoquímica. Así, el carcinoma histiocitoide es positivo para antígeno de membrana epitelial (EMA), citoqueratinas, y GCDFP-15; siendo negativo para CD-68, que sí expresan las células del infiltrado histiocítico. El mioblastoma de células granulares de la mama, un tumor poco frecuente de origen schwaniano, también puede presentar un problema de diagnóstico diferencial con el carcinoma histiocitoide, si bien pueden diferenciarse por la positividad de la proteína S-100 en el mioblastoma.
En las series publicadas, destaca la positividad de CK34beta-E12 y la negatividad de E-Cadherina en la mayoría de los casos de carcinoma histiocitoide (2,3), lo cual apunta a la naturaleza lobulillar de la lesión, dato que es apoyado por el hallazgo de componente de carcinoma lobulillar in situ varios de los casos. Sin embargo dicha expresión de E-Cadherina no es constante, por lo que no se puede descartar un origen ductal, ya que existen casos en la literatura (2) con expresión de E-Cadherina y CK34beta-E12 positivas, al contrario que ocurre con los lobulillares (13). Ha sido descrita, entre los de variante lobulillar, la expresión de receptores androgénicos (14).
Tanto por la controversia sobre su origen, como por la inexistencia de grandes series de casos, debido a su rareza, y también en gran medida a que ha existido una denominación común para todos los carcinomas histiocitoides, incluyendo las formas lobullillares pleomórficas apocrinas, no es posible determinar con exactitud el pronóstico, si bien la mayoría de trabajos indican un mal comportamiento, siendo típica las metástasis en párpado (5,15). Otros casos han sido diagnosticos en estadio I y los pacientes permanecen bien después de 5 años (8). Por ello, serían convenientes nuevos estudios que discriminasen entre las distintas formas de carcinoma histiocitoide: carcinoma lobulillar pleomórfico, la variante apocrina del carcinoma lobulillar clásico no pleomórfico y el carcinoma ductal apocrino de células de tipo A de la OMS.
De los dos casos de carcinoma histiocitoide que presentamos, uno de ellos debutó con 2 metástasis ganglionares axilares, y otro como carcinoma inflamatorio con linfangiectasia, confirmándose el mal pronóstico en ambos casos.
BIBLIOGRAFÍA
Eisenberg BL, Bacnall JW, Harding CT. Histiocytoid carcinoma: a variant of breast cancer. J Surg Oncol 2006; 31: 271-4.
Gupta D, Croitoru CM, Ayala AG, Sahin AA, Middleton LP. E-Cadherin immunohistochemical analysis of histiocytoid carcinoma of the breast. Ann Diagn Pathol 2002; 6: 141-7.
Eusebi V, Magalhaes F, Azzopardi JG. Pleomorphic lobular carcinoma of the breast: an aggressive tumor showing apocrine differentiation. Hum Pathol 1992; 23(6): 655-62.
Tavassoli FA, Devilee P. World Health Organization Classification of Tumours. Pathology and genetics of Tumours of the Breast and Female Genital Organs. Lyon: IARC Press; 2003: 24-6.
Hood Cl, Front RL, Zimmerman LE. Metastatic Mammary Carcinoma in the Eyelid With Histiocytoid Appearance. Cancer 1973; 31: 793-800.
Kempson RL, Rouse RV. Surgical Pathology Criteria. Stanford School of Medicine. Actualizado el 1 Mayo 2006. http://surgpathcriteria.stanford.edu/breast/histiocabr/index.html.
Abdulla M, Hombal S, Al-Juwaiser A, Nath M, Stankovich D, Kanbour A. Cytomorphologic features of classic and variant lobular carcinoma: a comparative study. Diagn Cytopathol 2000; 22: 370-5.
Shimizu S, Kitamura H, Ito T, Nakamura T, Fujisawa J, Matsukawa H. Histiocytoid breast carcinoma: histological, immunohistochemical, ultrastructural, cytological and clinicopathological studies. Pathol Int 1998; 48: 549-56.
Fujiwara M, Horiguchi M, Mori S, Yokoyama K, Horiguchi H, Fukazawa M, Fujiwara H, Yano Y, Satoh H, Kamma H. Histiocytoid breast carcinoma: solid variant of invasive lobular carcinoma with decreased expression of both E-cadherin and CD44 epithelial variant. Pathology International 2005; 55 : 353-9.
Frolik D, Caduff R, Varga Z. Pleomorphic lobular carcinoma of the breast: its cell kinetics, expression of oncogenes and tumour suppressor genes compared with invasive ductal carcinomas and classical infiltrating lobular carcinomas. Histopathology 2001; 39: 503-13.
Walford N, Ten Velden J. Histiocytoid breast carcinoma: an apocrine variant of lobular carcinoma. Histopathology 1989; 14: 515-22.
Eusebi V, Foschini MP, Bussolati G, Rosen PP. Myoblastomatoid (histiocytoid) carcinoma of the breast. A type of apocrine carcinoma. Am J Surg Pathol 1995; 19: 553-62.
Rieger-Christ KM, Pezza JA, Dugan JM, Braasch JW, Hughes KS, Summerhayes IC. Disparate E-cadherin mutations in LCIS and associated invasive breast carcinomas. J Clin Pathol: Mol Pathol 2001; 54: 91-7.
Augros M, Buénerd A, Devouassoux-Shisheboran M, Berger G. Infiltrating lobular carcinoma of the breast with histiocytoid features: three cases. Ann Pathol 2004; 24: 259-63.
Langel DJ, Yeatts RP, White WL. Primary signet ring cell carcinoma of the eyelid: report of a case demonstrating further analogy to lobular carcinoma of the breast with a literature review. Am J Dermatopathol 2001; 23: 444-9.