
Vol. 42, n.º 1, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 1, 2009 |
ARTÍCULOS INVITADOS
O. Ferrer Roca
Cátedra UNESCO de Telemedicina. CATAI. Facultad
de Medicina. Universidad de la Laguna. Tenerife.
www.teide.net/catai
RESUMEN
La gestión de muestras en un departamento de Anatomía Patológica se ve directamente afectada en España por la Ley de Protección de Datos, la Ley de Autonomía del Paciente y la Ley de Investigación Biomédica. Estas leyes influyen en aspectos tan trascendentales como que las muestras deben guardarse un mínimo de 30 años, que la utilización de las mismas para investigación requieren un Comité de Ética, que deben venir referidas con un consentimiento informado, que requieren una trazabilidad total, un alta en la base de datos de biobancos etc… Estos y otros de los aspectos que influyen directamente en la gestión de las muestras en un servicio de Anatomía Patológica son analizados en este artículo.
Palabras clave: Bio-banco, Colección bio-muestras, Protección datos, Pato-informática, Investigación biomédica, Legislación.
SUMMARY
Specimen management in a Anatomic Pathology department in Spain is directly affected by the Data Protection Act, the Patient Autonomy Law and the Biomedical Research Law. These laws affect transcendental aspects, such as how long samples must be kept (minimum 30 years), and enforce that an Ethics Committee must oversee the use of these samples in research, that these must come with informed consent, that they must be fully traceable, that they must be registered in biobank databases, etc. These and other aspects that invariably influence specimen management in Anatomic Pathology services are analysed in this article.
Keywords: Biobank, bio-specimen collection, Data Protection Act, pathology computing, biomedical research, legislation.
INTRODUCCION
Los servicios de anatomía patológica no pueden encontrarse al margen de los requerimientos que establece la legislación vigente en material de de investigación biomédica (LIB), protección de datos personales (LOPD) y protección de los derechos del paciente (LAP) (1-6), y además, deben cumplir los estándares de calidad y control de riesgos que establece la nueva directiva comunitaria de aparatos médicos (7-10).
Estas cuestiones reglamentarias, de extraordinaria importancia para una gestión sanitaria eficiente y un control de calidad y riesgo para el paciente, no se tratan adecuadamente, ni en la carrera de medicina ni en la especialidad de Anatomía Patológica. Sin embargo, como es bien sabido, este hecho no exime a los profesionales de su obligado cumplimiento.
Muchos de los aspectos que trataremos a continuación, y algunos otros que ya introducimos en un articulo anterior (11) están reconocidos en otros países dentro del campo de la «pathology-informatics» (12) o informática en la Anatomía Patológica, porque la mayoría de los conceptos, aunque no todos, están integrados en la gestión y protección de datos electrónicos del paciente. Algunos de ellos pertenecen también al área de la ingeniería biomédica y otros a la de telemedicina, particularmente los que obligan al control de calidad y a la utilización de estándares, por lo que no los trataremos en este articulo.
El hecho real es que la complejidad de estos aspectos alcanza un nivel que requiere especialistas en la materia y dentro de los departamentos de anatomía patológica se cuenta ya con servicios de informática en patología dirigida por especialistas tecnológicos en anatomía patológica.
Los elementos que estudiaremos en profundidad y que se ven afectados por la normativa que hemos especificado mas arriba son fundamentalmente: 1) Consideración de muestra biológica para las muestras de Anatomía Patológica; 2) Derechos de accesibilidad y conocimiento del paciente sobre sus datos; 3) La exigencia de trazabilidad de las muestras biológicas; 4) La exigencia de mantenimiento de las muestras biológicas; 5) El papel de los bancos de imágenes en la proteómica, genómica y metabolómica.
MUESTRAS BIOLÓGICAS EN ANATOMÍA PATOLÓGICA
En la gestión de biomuestras hemos de tener presente tres leyes fundamentales:
LOPD o Ley Orgánica de Protección de datos (LO 15/1999) y los reglamentos que la desarrollan (RD 994/1999 sobre medidas de seguridad y su última modificación en el año 2007, el RD-1720/2007).
LAP o Ley Orgánica de Autonomía del paciente (LO 41/2002).
LIB o Ley de Investigación Biomédica (LO 14/2007) que viene a definir y a determinar como gestionar las biomuestras.
Entre los principios fundamentales que aplican a la LOPD y a la LAP se han de tener en cuenta los que se listan en las tablas 1 y 2.


Aunque el «dato de salud» no viene definido en la LOPD, la definición dada en lar apartado 45 del convenio 108 Consejo Europa, se ha copiado literalmente en el reglamento de la ley RD-1720/2007 (art. 5g) «Datos de carácter personal relacionados con la salud: las informaciones concernientes a la salud pasada, presente y futura, física o mental, de un individuo. En particular, se consideran dato relacionados con la salud de las personas los referidos a su porcentaje de discapacidad y a su información genética».
CONCEPTO DE BIOMUESTRA O MUESTRA BIOLÓGICA
Según la Ley de Investigación Biomédica, una «Muestra biológica: es cualquier material biológico de origen humano susceptible de conservación y que puede albergar información sobre la dotación genética característica de una persona».
Por lo tanto, atendiendo a esta definición,
Cualquier material
extraído del paciente en un ACTO QUIRURGICO
debe procesarse como BIOMUESTRA.
Podemos interpretar que los datos genéticos tienen información de salud y además que una muestra biológica que se tome del paciente contiene información genética. Con lo cual es obligatorio que cumplan la Ley de Investigación Biomédica laboratorios que actualmente no cuentan con regulación como los de Anatomía Patológica, Hematología, Bioquímica etc.…. Esto implica que,
Los servicios de
ANATOMIA PATOLOGICA, HEMATOLOGIA y
LABORATORIO han de adaptarse a la Ley de Investigación Biomédica.
CALIDAD DE LOS DATOS
Según la ley de investigación biomédica LO 14/2007, son tratamiento de datos las «operaciones y procedimientos que permitan la obtención, conservación, utilización y cesión de datos genéticos de carácter personal o muestras biológicas».
Y, según la LOPD (Art 3.c) son tratamiento de datos « operaciones y procedimientos técnicos de carácter automatizado o no, que permitan la recogida, grabación, conservación, elaboración, modificación, bloqueo y cancelación, así como las cesiones de datos que resulten de comunicaciones, consultas, interconexiones y transferencias».
Entre las obligaciones de los responsables de ficheros (en la mayoría de las Comunidades Autónomas el responsable el la Consejería de Sanidad correspondiente) está la calidad de los datos (ver tabla 1) que han de ser adecuados, pertinentes y no excesivos.
Pero, igualmente como responsables tienen la obligación de asegurar de que el ciudadano puede ejercer sus derechos (ver tabla 2), que son los derechos fundamentales de la Ley de Protección de Datos LOPD, es decir, el ciudadano tiene el derecho de saber en todo momento donde está el material biológico que se la ha extraído y para qué se ha hecho servir. Esto implica:
Que los SERVICIOS
QUIRURGICOS y los de ANATOMIA PATOLOGICA
han de adaptarse a la Ley de investigación Biomédica.
En este sentido la TRAZABILIDAD del material extraído es algo fundamental y la falta de la misma recae directamente sobre la calidad de asistencia hospitalaria. Ya que el objeto del derecho a la protección de datos no es la intimidad/confidencialidad sino otros muchos más importantes que son los derechos del ciudadano sobre su material biológico.
TRAZABILIDAD EXIGIDA PARA MUESTRAS BIOLÓGICAS
El derecho del paciente a saber donde está la muestra y para que se ha utilizado se extiende más allá de donde esté ubicada la muestra, incluso en caso de que se deseche o se lleve a un almacén externo o se dé de baja el material (ver Muestras Asistenciales).
Es decir, una vez obtenida la muestra biológica se ha de asegurar su trazabilidad durante todo el proceso
Guardando los datos genéticos durante 5 años después de que se hayan obtenido.
Los datos deben «anonimizarse» si el paciente o el donante así lo reclaman.
Sólo personal autorizado puede acceder a los datos personales.
Primer responsable
La trazabilidad de la muestra biológica debería iniciarse en el quirófano y darse de alta el los ficheros del HIS hospitalario, que es el que está dado de alta en la Agencia de Protección de Datos. Si no se lleva a cabo en el mismo, debe iniciarse en el lugar donde se dirija la muestra: Laboratorio de Anatomía Patológica, Hematología, Microbiología, Análisis Clínicos etc.
En este momento debe llevar un identificador único ligado al paciente de forma inequívoca, que facilite los intercambios de información, imágenes macro y microscópicas tanto en el Laboratorio de Anatomía Patológica como durante el acto quirúrgico, muy especialmente en los casos de biopsias peroperatorias múltiples, y conexión directa entre anatomía patológica y quirófano, aspectos estos relacionados con la telemedicina y que trataremos en otro artículo.
La forma menos elegante es la numeración a la entrada en Anatomía Patológica, la forma mas elegante es el código de barras o el identificador RFID (radiofrequency identification). Esto implica renovar y actualizar los sistemas de etiquetado de las muestras para su incorporación automática al HIS hospitalario.
Como hemos visto anteriormente, es el Servicio de Cirugía el que decide en primera estancia sobre el tipo de muestra, y por esto debe saber distinguir si la ley es o no aplicable en las muestras extraídas en quirófano.
En caso de no ejercitar esta función, el siguiente receptor debe llevarla a cabo. En este caso estaríamos hablando del Departamento de Anatomía Patológica.
Esto hace que los médicos y técnicos responsables deban tener conocimiento de la Ley de Investigación Biomédica y de la opinión de la agencia de Protección de datos sobre lo que es una MUESTRA BIOLOGICA y la información que contiene.
Para ello es fundamental conocer los tipos de muestras biológicas.
TIPO DE MUESTRAS BIOLÓGICAS
Aunque es el cirujano el responsable primero de la obtención de las muestras biológicas y por lo tanto, el que ha de prestar especial atención no solo en su procesado asistencial sino en su cesión al área de investigación biomédica de los biobancos (porque en este caso la información deberá estar registrada igualmente en los registros de biobancos). Si el Departamento de Cirugía no realiza esta función por la razón que sea, deberá ser el laboratorio al que va dirigida la muestra el que la realice.
Todo repositorio de muestras biológicas puede ser o bien una COLECCIÓN y por lo tanto no sujeta a la Ley de Investigación o un BIOBANCO y por lo tanto sujeta a la misma.
Colección
Repositorio de muestras que están UNICAMENTE utilizadas por el dueño de las mismas.
Por lo tanto a diferencia de los biobancos no debe estar organizado como un servicio y puede tener ánimo de lucro. Ver mas abajo los aspectos ético-organizativos.
Biobanco
Es una institución sin ánimo de lucro pública o privada propietaria de un repositorio de material biológico dedicado a la INVESTIGACION o a FINES DIAGNOSTICOS, y cuyas muestras están organizadas como una unidad tecnica con criterios de calidad, orden y destino del material.
Un BIOBANCO es un
repositorio de muestras biológicas
que están disponibles para la comunidad científica.
Es decir se DEFINE como un (i) Establecimiento que maneja (ii) Un repositorio de muestras biológicas (iii) Además de su información clínica (iv) Que esta organizado como un Servicio (v) Con una diseño claro y con criterios éticos y de calidad (vi) Para un propósito diagnostico o de investigación biomédica.
Y su FUNCION puede ser asistencial o de investigación siendo esta distinción trascendental para determinar la CALIDAD DE LOS DATOS (es decir que datos voy a obtener y para que)
a) Muestras NO ASISTENCIALES
Para actividades NO ASISTENCIALES es de obligado cumplimiento la Ley de Autonomía del Paciente (LAP) y por lo tanto, el material sanitario solo puede obtenerse con dos supuestos:
– Obteniendo consentimiento informado de acuerdo LODP,
– Disociando los datos del titular de la información. Pero sabemos que en muestras biológicas esto no es posible de acuerdo con la opinión de la Agencia de Protección de Datos (13).
Según la Agencia de
Protección de Datos en la muestra biológica
NO HAY POSIBILIDAD DE DISOCIACION DE DATOS.
Este supuesto abarca el uso para investigación de las muestras obtenidas en quirófano, almacenadas en Anatomía Patológica o en cualquier Laboratorio. Y por lo tanto, debe obligatoriamente aplicarse en las muestras que, habiéndose obtenido dentro de la función asistencial hospitalaria, van a ser dedicadas o se utilizarán en investigación. Esto implica la práctica totalidad de las muestras de Anatomía Patológica en un hospital universitario o en un centro donde se haga investigación médica.
Consentimiento informado
El consentimiento tácito es el que se emplea cuando el paciente llega a su centro de asistencia o de asistencia voluntaria. Este es el que se utiliza en todos los centros sanitarios.
Sin embargo,
No hay consentimiento
tácito para la investigación, que es lo que se hace
en las Facultades de Medicina ligadas a los Hospitales Universitarios.
Cualquier otro uso no asistencial requiere informar al titular de la muestra y obtener su consentimiento.
Esto implica que se ha de modificar totalmente la forma de recogida de muestras hospitalarias, muy particularmente si éste es un hospital clínico. Como el servicio encargado de la recogida es, en la mayoría de los casos, el servicio quirúrgico (a excepción extracción sangre y productos de desecho), ha de ajustar su consentimiento informado a tal hecho.
Cesión a terceros
Otro principio fundamental que impera de acuerdo con la Agencia de Protección de datos (13) es que
Los usos distintos
a los asistenciales diagnósticos se
consideran una cesión a terceros
Como gestionar la cesión a terceros se explica más abajo.
No sirve el criterio de disociación de datos en la investigación porque la DISOCIACION HA DE SER IRREVERSIBLE. Además, en una muestra biológica, que evidentemente tiene información genética, es totalmente imposible la disociación irreversible.
b) Muestras ASISTENCIALES
Si la muestra se ha
obtenido para finalidades asistenciales, esta muestra no esta
legitimada para ser utilizada para otra finalidad como la investigación,
genética u otra
de acuerdo con el principio de la CALIDAD DE LOS DATOS de la LOPD.
Tanto las muestras de citológicas como las de patología quirúrgica contienen información genética bien conservada gracias a las técnicas actuales de procesado y por lo tanto a la larga o a la corta deberán tratarse como biobancos y será de aplicación los criterios de trazabilidad, conservación y disociación de los datos personales aplicables a la ley de biobancos.
Almacenamiento-Cesión a terceros
Esta consideración, evitaría hechos tan graves dentro del control de calidad hospitalario como la pérdida de muestras biológicas una vez transportadas al lugar de almacenamiento común y mejoraría la trazabilidad general del proceso desde su toma.
Estos aspectos no quedan recogidos en los estudios de control de calidad hospitalaria o de los laboratorios, ya que por ley pueden desechar las muestras a los 5 años.
Por ley, estas muestras biológicas y sus derivados tienen obligatoriamente que tener los datos disociados una vez se lleva a un almacén como explicamos en el apartado de cesion a terceros de las muestras no asistenciales.
El almacén además debe
tener obligatoriamente un CONTRATO
de acuerdo de cesión de muestras biológicas a terceros.
Porque ya hemos dicho que el uso para investigación de una muestra asistencial forma parte del principio de cesión de datos a terceros. Es decir el paso de la asistencia al biobanco para luego hacer investigación implica que EL TITULAR DE LA MUESTRA DEBE SABER PARA QUE SE ESTA UTILIZANDO y el titular de la muestra es, como bien se sabe, el paciente.
Y aunque la Ley de investigación biomédica cree que se debe dar un consentimiento genérico, que una vez dado con carácter inicial puede utilizarse para otra investigación, esto es algo que entra en colisión LOPD y que no admite la Agencia Nacional de Protección de datos (13).
Trazabilidad y permanencia
La trazabilidad afecta a TODOS los PRODUCTOS DERIVADOS como los bloques de parafina, las preparaciones y la citología, por ejemplo. De ahí que en estos últimos sea tan importante poder contar con archivos de preparaciones virtuales (14) asociadas a la historia clínica que eviten la perdida o no trazabilidad de los mismos (fig. 1).
Fig. 1:
Preparaciones virtuales de pequeño tamaño. SSVS© Ferrer-Roca o small
size virtual slide (14).
Ya hemos tratado en el apartado de trazabilidad de las muestras biologicas la importancia que ésta tiene para la calidad asistencial y quién es el primer responsable.
En éste vamos a tratar la permanencia: La ley de Autonomía del Paciente indica que la información se puede guardar como mínimo obligatorio 5 años, y luego puede conservarse con carácter disociado. Si se va a almacenar información de carácter personal, ha de hacerse de forma que se garanticen los derechos.
La ley de autonomía
del paciente indica que la información se tiene que
conservar un mínimo 5 años, y siempre si es de utilidad
asistencial.
Sin embargo
La Ley de investigación Biomédica obliga a la trazabilidad durante 30 años.
O lo que es lo mismo, el material biológico que se encuentra en laboratorios como el de Anatomía Patológica debe tener trazabilidad durante 30 años y no puede archivarse perdido en un almacén de terceros.
OTROS BIOBANCOS
Biobanco citológico (fig. 2)
Las actuales técnicas inmunohistoquímicas, de miniaturización y de recogida de las muestras no necesitan una gran cantidad de material, sino que una mínima cantidad de células es suficiente. Esto convierte a los Servicios o Secciones de Citología en los herederos de la gestión de los biobancos y muestras biológicas (15).

Fig. 2:
Papel de los biobancos citológicos (15).
Hoy en día la medicina molecular y las técnicas de terapia personaliza se fundamentan en muestras citológicos donde se localizan las dianas terapéuticas en la subespecialidad de la Anatomía Patológica que se ha dado en llamar Farmacopatología. Los marcadores de fosforilación, las tirosinkinasas, el EGFR/HER1, HER2 o el c-Kit se detectan fundamentalmente en muestras citológicas tomadas por punción (16).
Biobanco de Anatomía Patológica (fig. 3)
De la misma manera que de las muestras citológicas se obtiene información genética, de la totalidad de las muestra macro, micro y de los bloques de parafina se obtienen hoy en día información relevante sobre los datos genéticos, familiares, hereditarios, terapéuticos etcétera.
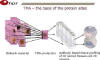
Fig. 3:
Atlas de proteínas humanas Sueco (HPA, human
protein atlas or human proteome resource) basado en TMA o tissue
microarrays. Cuyas preparaciones virtuales se realizan con el Aperio
Scanscope.
http://www.proteinatlas.org/object.php
Es obvio por lo tanto que un Servicio de Anatomía Patológica deba estar gestionado como un biobanco y más si este se encuentra en una Facultad de Medicina y por lo tanto ofrece muestras para investigación a la comunidad científica.
Aspectos éticos
Este hecho tiene varias connotaciones etico-organizativas de considerable trascendencia, ya que,
– Una vez finalizado su valor asistencial, la muestra debe estar disponible siguiendo la Ley de Investigación Biomédica para la comunidad científica y no puede haber limitaciones de tipo arbitrario o personal en esta cesión, sino que deben estar controladas y limitadas por un Comité Ético.
El fundamento de la misma es que no se puede gestionar un archivo de Anatomía Patológica como una colección personal de la que es propietario uno o varios miembros del departamento de Anatomía Patológica.
Fuera de su función
asistencial durante 5 años, un archivo de piezas o de muestras
de CITOLOGIA ó ANATOMIA PATOLOGICA es un biobanco y como tal requiere
por ley un COMITÉ ÉTICO para la gestión de las muestras.
– No puede permitirse un almacenamiento indiscriminado de las muestras ni una cesión a terceros en un almacén, debiendo mantenerse la trazabilidad así como la disociación de datos un mínimo de 30 años, al menos en los hospitales universitarios.
CONCLUSIÓN
Es fundamental tener en las Comunidades Autónomas una Agencia Autonómica de Protección de Datos capaz de aconsejar a los Servicios de Salud y a los sistemas sanitarios sobre estos aspectos tan complejos y gestionar consentimientos informados adecuados para que incluyan obligaciones conjuntas sobre LOPD, Ley de Autonomía del Paciente y Ley de Investigación Biomédica. Teniendo en cuenta que la Ley de Investigación Biomédica requiere la constancia por escrito.
Junto a esto, todos los Departamentos de Anatomía Patológica han de estar preparados para ser gestionados como biobancos antes y después del periodo asistencial de 5 años.
BIBLIOGRAFÍA
Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal. BOE de 14 de diciembre de 1999. Disponible en http://www.boe.es/g/es/bases_datos/doc.php?coleccion=iberlex&id=1999/23750
Convenio n.º 108 del Consejo de Europa para la protección de las personas con respecto al tratamiento automatizado de datos de carácter personal. Estrasburgo, 28 de enero de 1981. Disponible en http://www.apdcat.net/media/246.pdf
Recomendación n. R (97) 5, de 13 de febrero de 1997, del Comité de Ministros del Consejo de Europa a los Estados miembros sobre Protección de Datos Médicos. Disponible en http://www.bioeticaweb.com/index2.php?option=com_content&do_pdf=1&id=902
Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Disponible en http://noticias.juridicas.com/base_datos/Admin/l41-2002.html
Real Decreto 1720/2007, de 21 de diciembre, por el que se aprueba el Reglamento de desarrollo de la Ley Orgánica 15/1999, de 13 de diciembre, de protección de datos de carácter personal. Disponible en http://www.boe.es/boe/dias/2008/01/19/pdfs/A04103-04136.pdf
Ley 14/2007, del 3 de julio, de investigación biomédica. BOE de 4 Julio del 2007. Disponible en http://www.boe.es/boe/dias/2007/07/04/pdfs/A28826-28848.pdf
ISO/IEEE 11073 o estándar plug & play. Disponible en www.ieee1073.org
IEC 60601-1: 2006. Seguridad en los equipos electromédicos incluyendo los PESS o subsistemas electrónicos programables. Disponible en http://www.tecno-med.es/boletin/60601-1aprobacion-cenelec.pdf
ISO 14971:2007 specifies a process for a manufacturer to identify the hazards associated with medical devices. Disponible en http://www.iso.org/iso/iso_catalogue/catalogue_tc/catalogye_detail.htm?csnumber=38193.
DIR 2007/47/EC Nueva directiva sobre equipos médicos. Disponible en http://en.wikipedia.org/wiki/Medical_device
Ferrer-Roca O, Franco K, Pulido P, Escobar P, Cardenes A. Firma electrónica y manejo de privilegios en sanidad. Rev Esp Patol 2003; 36: 171-80. Disponible en http://www.pgmacline.es/revpatologia/volumen36/vol36-num2/36-2n07.htm
Pathology-informatics. Disponible en http://www.pathologyinformatics.org/,http://path.upmc.edu/cpi/
Igualada A. Régimen jurídico de protección de datos en el marco de la ley de Investigación Biomédica. En: Ferrer-Roca O, editor. Quality control in Telemedicine. Biobanking. Tenerife: Ed. Ediciones Catai; 2007. P: 61- 67. ISBN 978-84-612-1364-1.
Ferrer-Roca O, Marcano F, Quintana JJ. Small size virtual slides in pathology. Virchows Arch 2008; 452: s9-s10.
Bibbo M, Åkerman M, Alves VAF, Bubendorf L, Colgan TJ, Itoh H, et al. How Technology Is Reshaping the Practice of Nongynecologic Cytology: Frontiers of Cytology Symposium. Acta Cytol 2007; 51: 123-52.
Schmitt FC. Image Biobanking: Biomaterial to personalized cancer diagnosis and treatment. En: Ferrer-Roca O, editor. Quality control in Telemedicine. Biobanking. Tenerife: Ed. Ediciones Catai; 2007. P: 68-72. ISBN 978-84-612-1364-1.