
Vol. 41, n.º 4, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 4, 2008 |
REVISIONES
José I. López1, Aitziber Ugalde2, Francisco J. Ortega1, Juan R. Vilanova1
Hospital de Cruces. Plaza de Cruces, s/n. 48903
Cruces, Barakaldo.
1 Departamento de Anatomía Patológica. Hospital de Cruces.
Universidad del País Vasco (EHU/UPV). Barakaldo, Bizkaia.
2 Servicio de Anatomía Patológica. Hospital de Basurto. Bilbao,
Bizkaia.
RESUMEN
El oncocitoma y el carcinoma de células cromófobas son dos entidades perfectamente reconocidas en la clasificación vigente de las neoplasias renales. Ambas neoplasias están muy interrelacionadas y parece que se originan en la zona distal de la nefrona. A pesar de estar perfectamente definidas desde el punto de vista histológico, en la práctica diaria los límites entre ambas neoplasias siguen siendo confusos y, desafortunadamente, la llegada de las nuevas técnicas diagnósticas a nuestros laboratorios no ha resuelto el problema. La aproximación actual consiste en considerar al conjunto de tumores oncocíticos renales como un espectro de lesiones en el cual el oncocitoma y el carcinoma de células cromófobas son los dos extremos. Sin embargo, la experiencia clínica demuestra que hay demasiados casos a medio camino, en tierra de nadie, en los cuales el patólogo se encuentra con grandes dificultades diagnósticas y con la imposibilidad de predecir su comportamiento biológico. El panorama se complica aún más si se tiene en cuenta que el carcinoma renal de células claras muestra con cierta frecuencia citoplasmas eosinófilos granulares, lo cual hace aún más problemático el diagnóstico diferencial. En este trabajo se revisa de manera crítica la literatura existente en este campo.
Palabras Clave: Oncocitoma renal, carcinoma de células cromófobas, carcinoma renal de células claras, tumor oncocítico atípico, diagnostico diferencial.
SUMMARY
Oncocytoma and chromophobe cell carcinoma are two well recognised histological entities in the current classification of renal tumours. Both entities are closely related and arise in the distal nephron. In spite of the fact that both tumours are sharply defined from the pathological point of view, the boundary between them still remains confusing in daily practice and the arrival of new diagnostic techniques to our Labs has not resolved the problem. The current approach to the issue considers all renal oncocytic neoplasms within a spectrum of lesions in which oncocytoma and chromophobe renal cell carcinoma are the two extreme points. However, the clinical experience shows that there are too many cases «in between», in which the pathologist has a lot of difficulties for making a reliable diagnosis and often is unable to predict the clinical behaviour. The differential diagnosis may be even more complicated if the eosinophilic variant of clear cell carcinoma is taken into account. This study reviews the literature on this topic in critical way.
Keywords: Renal oncocytoma, chromophobe renal cell carcinoma, clear cell renal cell carcinoma, atypical oncocytic tumour, differential diagnosis.
INTRODUCCIÓN
El diagnóstico anatomopatológico de los tumores renales oncocíticos, y la predicción pronóstica que conlleva, es hoy en día un terreno confuso y resbaladizo para el patólogo que se ve, por un lado rodeado como nunca de técnicas diagnósticas superespecializadas, y por otro, enfrentado a una serie de tumores que se sitúan a medio camino entre el oncocitoma clásico (OR) y el carcinoma de células cromófobas (CRCCr), y de los que no sabe, ni puede predecir, prácticamente nada. Es un terreno mal definido que ha venido en llamarse la neoplasia oncocítica atípica renal.
La primera mención al OR en la literatura corrió a cargo de Zippel en 1942 (1), cuando describió un peculiar tumor renal compuesto por oncocitos. No obstante, el OR no adquirió suficiente notoriedad en la literatura anatomopatológica hasta que Klein y Valensi en 1974 (2) publicaron una serie de 13 casos enfatizando la singularidad de este tumor del cortex renal. A partir de entonces la célula oncocítica fue fácil de reconocer por los patólogos clásicos debido a sus peculiaridades histológicas únicas: amplios citoplasmas intensamente eosinófilos y granulares, núcleos centrales, sin atipias, abundantes mitocondrias… De hecho, el patólogo de no hace muchos años se sentía bastante cómodo ante un tumor renal tan sencillo de identificar como éste, el concepto permaneció prácticamente inamovible durante décadas, y estuvo asociado invariablemente a benignidad.
Con todo, la clínica demostró que algunos OR se comportaban como tumores malignos, mostrando capacidad metastatizante y provocando en muchos casos la muerte del paciente. Thoenes y cols., a finales de los 80, describieron el CRCCr en sus variantes clásica (3) y eosinofílica (4), y el problema de inseguridad diagnóstica generado pareció resolverse al contar con criterios histológicos, histoquímicos y ultraestructurales objetivos para identificar a estos nuevos tumores. La realidad, empero, ha venido a demostrar que el problema es más complejo de lo que se pensó en un principio, con ejemplos ocasionales que desafían las reglas actualmente establecidas (5).
La existencia de ambos tumores, entendidos como entidades anatomopatológicas propias pero relacionadas, está fuera de toda duda. De hecho, la última clasificación de la OMS (6) considera que ambas entidades proceden de la misma zona de la nefrona. Sin embargo, cuando se tiene en consideración la evolución clínica de muchos de estos tumores, quedan sin aclarar algunos puntos importantes, por ejemplo, ¿qué se hace con los OR diagnosticados según criterios estrictos y que metastatizan (7,8) causando incluso la muerte del paciente (9)?, ¿cómo se explica la existencia de CRCCr histológicamente genuinos que se curan (10,11)?, ¿cuáles son las características morfológicas, inmunohistoquímicas, ultraestructurales, y moleculares, intrínsecas y objetivas que permiten al patólogo decidir, con un grado de confianza suficiente, qué casos atípicos, incompletos, o que a posteriori han presentado un curso clínico inesperadamente benigno o maligno, son OR y qué casos son CRCCr?
El tercer elemento en discordia de esta revisión es el carcinoma renal de células claras (CCRCC). Esta variedad de cáncer renal es con mucho la más frecuente entre los tumores renales de adultos (6). No es, sensu estricto, una neoplasia oncocítica, ni se origina en la misma zona de la nefrona, pero con relativa frecuencia muestra células con citoplasmas intensamente eosinofílicos que pueden ser interpretadas erróneamente como oncocíticas. Esta peculiaridad morfológica se conoce desde antiguo y, aunque ya no se recomienda esta terminología, estos tumores han venido refiriéndose en la literatura como carcinomas renales de células granulares.
Esta revisión pretende abordar este problema diagnóstico tan confuso de una manera crítica.
ONCOCITOMA RENAL
Entre la profusión de publicaciones sobre el OR, existen seis series principales que describen las características morfológicas de este tumor (9,12-16). En 1997, tras un minucioso análisis de 70 casos, Pérez-Ordóñez y cols (9) se reafirman en la distinción del OR de otras neoplasias corticales renales, poniendo de manifiesto la existencia de un espectro morfológico más amplio del hasta entonces conocido y concluyendo que la práctica totalidad de los OR metastáticos publicados hasta entonces representaban en realidad carcinomas renales, bien cromófobos o de células claras. En el mismo año, Amin y cols (13) atribuyen los casos de OR metastáticos bien a carcinomas renales de citoplasma granular, o eosinofílico, entre los que se incluyen el CCRCC, el CRCCr, y algunos carcinomas renales papilares. Ambas revisiones reafirman la naturaleza benigna del OR al que asignan características macro y microscópicas propias y reproducibles, y lo separan de otras neoplasias con las que el OR puede compartir algunos rasgos morfológicos (9,13).
Entre los datos morfológicos típicos, y desde el punto de vista macroscópico, el OR es un tumor bien circunscrito pero no encapsulado, normalmente de color marrón oscuro, que puede mostrar una cicatriz fibrosa central, así como focos de hemorragia y/o cambios quísticos. Histológicamente, el tumor está constituido por células poliédricas de pequeño tamaño, con citoplasmas eosinofílicos granulares y núcleos centrales cromáticos de contorno regular (fig. 1). Las células se disponen formando nidos sólidos pequeños de aspecto «organoide» en un estroma variablemente hialinizado o mixoide (fig. 2). Además de este patrón de crecimiento clásico, pueden observarse áreas quísticas (fig. 3), túbulo-quísticas, pseudoglandulares, o sólidas (fig. 4). En las zonas con fibrosis estromal, o en vecindad de la cicatriz central si es que la hay, las células pueden mostrar un cierto aclaramiento del citoplasma (fig. 5) haciéndolas en parte semejantes a las células del carcinoma renal de células claras. De manera dispersa pueden observarse, de forma suelta o en pequeños grupos, células de talla pequeña, con alta relación núcleo/citoplasma y núcleo hipercromático denominadas por algunos «oncoblastos» (9). La tinción del hierro coloidal es típicamente negativa.
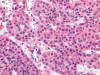
Fig. 1.
Nidos de células poliédricas con núcleo central,
regular y cromático, sin mitosis, y citoplasma granular eosinofílico típico del
oncocitoma renal (H&E, x250).
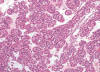
Fig. 2.
Patrón arquitectural formando nidos y cordones
celulares inmersos en un estroma edematoso característico del oncocitoma renal
(H&E, x40).
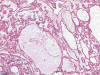
Fig. 3.
Patrón arquitectural túbulo-quístico en
oncocitoma renal (H&E, x40).
Fig. 4.
Patrón arquitectural sólido en pequeños nidos en
oncocitoma renl (H&E, x100).
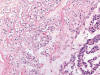
Fig. 5.
Área central con esclerosis en un oncocitoma
renal mostrando aclaramiento de los citoplasmas (H&E, x100).
Podría decirse que lo expuesto hasta ahora pertenece, con un buen margen de seguridad, al concepto de OR en el que el comportamiento benigno puede asegurarse con buen margen de seguridad. De hecho, Romis y cols. (15) y Gudbjartsson y cols. (16) consideran en sus respectivas series que la cirugía radical es hoy día un tratamiento excesivo en estos casos, proponiendo la obtención de cilindros biopsia por punción con control ecográfico, la ablación por radiofrecuencia o por crioterapia, y un seguimiento clínico estrecho, como la estrategia más apropiada en estos casos. Esta práctica está muy extendida en la actualidad y ha tenido buenos resultados en nuestra experiencia (17).
Los hallazgos «atípicos» en el OR comienzan con la atipia citológica entendida como pleomorfismo nuclear, anisomorfismo celular, presencia de nucleolos prominentes, y/o mitosis. Dichos cambios nucleares pueden aparecer de manera focal o difusa en hasta el 50% de los casos (9,13). Estos datos, y otros que se detallarán en apartados posteriores de este trabajo, se asocian de manera impredecible a comportamientos clínicos inesperados, y sitúan al OR al borde de las neoplasias oncocíticas atípicas o, lo que es lo mismo, al borde de los tumores sobre los que los patólogos no pueden decir gran cosa en cuanto a pronóstico con margen de seguridad suficiente.
El patrón inmunohistoquímico del OR está bien perfilado (18,19), pero tampoco soluciona el problema en el 100% de los casos (tabla 1). Los OR son positivos con CD117, CD15 (fig. 6), e-cadherina (fig. 7), RON, citoqueratinas de bajo peso molecular, especialmente con CK20 (figs. 8 y 9), con panqueratinas y, en el 75% de los casos, con EMA. De forma típica, existe un patrón de tinción paranuclear «en punto» (dot-like) con queratinas 7, 8 y 19. El OR es negativo con vimentina, queratinas de alto peso molecular, CD10 y con el marcador de carcinoma renal. Algunos estudios recientes (19) encuentran 100% de especificidad y de sensibilidad en el diagnóstico diferencial entre OR, CRCCr y carcinoma de células claras utilizando vimentina, glutation S-transferasa · (GST-a) y molécula de adhesión epitelial (EpCAM), aunque estos anticuerpos son menos utilizados en los laboratorios de nuestro ámbito.
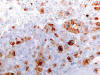
Fig. 6.
Expresión de CD15 en oncocitoma renal (CD15 y
hematoxilina, x250).
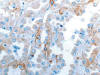
Fig. 7.
Expresión de e-cadherina con patrón de membrana
típico en oncocitoma renal (e-cadherina y hematoxilina, x250).
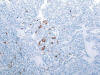
Fig. 8.
Expresión focal de CK7 en oncocitoma renal (CK7 y
hematoxilina, x100).
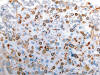
Fig. 9.
Expresión de CK20 en oncocitoma renal (CK20 y
hematoxilina, x250).
Desde el punto de vista ultraestructural, el OR muestra de manera característica citoplasmas rellenos de mitocondrias con crestas de predominio laminar y escasas microvesículas (20).
Se han descrito dos tipos de alteraciones genéticas en el OR (21): reordenamientos genéticos en la región 11q13 y pérdidas combinadas de los cromosomas 1 y X/Y. Los cambios en el cromosoma 1 afectan a 1p más que al cromosoma completo. No se han detectado alteraciones significativas en los genes reparadores de ADN (22).
Estudios fluorimétricos para 5 peptidasas [N-aminopeptidasa (CD13), endopeptidasa neutra (CD10), dipeptidil-peptidasa IV (CD26), cistinil-aminopeptidasa, y B-aminopeptidasa] han demostrado un significativo descenso en la actividad de todas ellas en el tejido tumoral respecto del tejido renal sano adyacente (López y cols, observación no publicada).
CARCINOMA RENAL DE CÉLULAS CROMÓFOBAS
Existen muy escasas variaciones entre las primeras descripciones (3,4) y las series actuales (10,23,24) en lo que respecta a las características histológicas del CRCCr. A pesar de ello, el diagnóstico de estos tumores no ha estado nunca exento de problemas. Así, Abrahams y cols (24) demuestran en un trabajo reciente que una pequeña pero significativa proporción de tumores renales que tienen citoplasmas eosinofílicos no pueden ser tipificados en base a los hallazgos puramente histológicos incluso por patólogos experimentados, necesitándose en esos casos «difíciles» la ayuda de la inmunohistoquímica.
Podemos considerar como un CRCCr típico (3,10, 23,24) aquél que cumple las siguientes características: tumor sólido (fig. 10) de borde expansivo, a menudo con cápsula fibrosa (fig. 11), de color marrón oscuro, sin necrosis o hemorragias aparentes, con propensión a afectar la médula renal (fig. 12), compuesto por células de aspecto "vegetal", con membranas citoplásmicas nítidas y citoplasmas reticulados eosinófilicos, y núcleos cromáticos, con binucleación frecuente, halo perinuclear claro y escasas mitosis (fig. 13). La variedad eosinofílica de este tumor muestra células más pequeñas con citoplasmas granulares intensamente eosinofílicos (4) (fig. 14). La neoplasia muestra una vascularización escasa comparada con el carcinoma de células claras, y tiene una disposición de sus células en nidos o cordones, aunque éstos se disponen de manera mucho más compacta que el OR. Ocasionalmente puede presentar transformación sarcomatoide (25). Desde el punto de vista histoquímico, el tumor es positivo con la técnica del hierro coloidal, lo cual lo distingue del OR, que es característicamente negativo. En la práctica diaria, esta forma de distinguir ambas entidades es a menudo poco fiable ya que la realización de la técnica debe ser exquisita y los resultados no siempre son «blanco o negro».
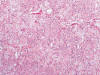
Fig. 10.
Patrón arquitectural sólido formando nidos
compactos en el carcinoma renal de células cromófobas (H&E, x100).
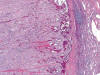
Fig. 11.
Cápsula fibrosa separando el carcinoma renal de
células cromófobas y el parénquima renal adyacente (H&E, x40).
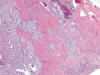
Fig. 12.
Carcinoma renal de células cromófobas invadiendo
el tejido fibroso perirenal (H&E, 40).
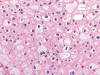
Fig. 13.
Celularidad característica en el carcinoma renal
de células cromófobas mostrando bordes citoplasmicos evidentes y citoplasmas
eosinófilos de aspecto floculento (H&E, x250).
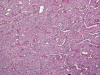
Fig. 14.
Variedad eosinofílica del carcinoma renal de
células cromófobas mostrando un patrón arquitectural sólido compuesto por
células de menor tamaño y citoplasms eosinofílico intenso (H&E, x100).
Existen múltiples evidencias clínicas de que el CRCCr tiene mejor pronóstico que el carcinoma renal de células claras (11,26,27). Un vistazo a las cifras de supervivencia de esta entidad en algunas series puede incluso llevar a la duda de si en verdad el CRCCr es un tumor maligno. Los datos a este respecto son muy elocuentes. Así por ejemplo, la supervivencia y la muerte relacionada con el tumor a 5 años se sitúan alrededor del 85% (10,26,27) y del 8,6% (26), respectivamente. Es más, algunos autores (11) no encuentran en su serie fallecimiento alguno relacionado con el tumor. En la experiencia de Onishi y cols (10) casi la mitad de sus pacientes, exactamente el 47%, sobrevivían tras 20 años de seguimiento. Estos datos dejan sin respuesta algunas preguntas y muchas incógnitas están abiertas hoy en día a la simple especulación. Por si todo esto fuera poco, el problema se complica aún más si se tiene en cuenta a la variante eosinofílica del CRCCr. Esta última variedad histológica, tan parecida al OR en cortes de hematoxilina-eosina, se comporta aún mejor que la variante clásica, mostrando en comparación con ésta una estadificación más baja al diagnóstico y un menor grado, sin fallecimientos relacionados con el tumor (10,11).
El perfil inmunohistoquímico más común en el CRCCr consiste en positividad intensa para CK7, EMA, MUC1, e-cadherina, CD117, EpCAM y parvalbúmina (18,19), siendo negativos la vimentina, CK20, CD10, marcador del carcinoma renal, p504S, GST-a, y queratinas de alto peso (tabla 1). La combinación de CD15, CK7 y CK20 parece ser la más fiable y accesible para distinguir el CRCC del OR (18).
Ultraestructuralmente, el CRCCr ha sido exhaustivamente estudiado (20,28). Destaca la presencia de microvellosidades cortas, la abundancia de microvesículas, y las mitocondrias anómalas. Existe un predominio de mitocondrias de crestas tubulares o túbulo-vesiculares, con proyecciones de yemas desde la membrana externa mitocondrial e imágenes de vesículas dentro de vesículas intramitocondriales, lo cual apoya la idea del origen mitocondrial de las microvesículas (24) y acerca desde este punto de vista el CRCCr al OR. Más aún, las variantes eosinofílicas del CRCCr muestran abundancia de mitocondrias con crestas laminares similares a las del OR, y menor número de microvesículas (20).
La pérdida de cromosomas 1, 2, 6, 10 y 17 caracteriza al CRCCr, tanto a la variante clásica como a la eosinofílica (29), y al menos desde el punto de vista genético une ambas histologías y las aleja del OR, en donde sólo se detecta pérdida de 1p (21). Al igual que en el OR, no se han detectado alteraciones significativas en los genes reparadores de ADN en el CRCCr (22).
El estudio fluorimétrico de las mismas 5 peptidasas mencionadas en el apartado anterior [N-aminopeptidasa (CD13), endopeptidasa neutra (CD10), dipeptidil-peptidasa IV (CD26), cistinil-aminopeptidasa, y B-aminopeptidasa] muestra el mismo patrón de expresión que en el OR, con significativos descensos al comparar tejido tumoral con tejido sano, lo cual no permite utilizar esta herramienta en el diagnóstico diferencial entre ambos tumores pero si apoya el origen común de ambos (López y cols, observación no publicada).
TUMORES ONCOCÍTICOS ATIPICOS RENALES
Los tumores oncocíticos pueden ser atípicos desde el punto de vista morfológico o desde el punto de vista clínico, y ambos puntos de vista pueden no ir necesariamente paralelos. Histológicamente, se consideran neoplasias oncocíticas atípicas bien aquellas que no cumplen los criterios histológicos estrictos de OR o de CRCCr, o bien los tumores híbridos, es decir, aquellos que contienen áreas identificables de ambos formando parte del mismo tumor. La distinción histológica es, en algunos casos, complicada y los límites entre CRCCr convencional, su variante eosinofílica, y el OR puede llegar a ser inapreciables (10). Desde el punto de vista clínico, un OR estrictamente diagnosticado que metastatiza (7,8), o que incluso causa la muerte del paciente (9), y un CRCCr genuino que sobrevive sorprendentemente a los 20 años (10) pueden considerarse también como atípicos y desafían la validez y fiabilidad de los parámetros histológicos, inmunohistoquímicos, y moleculares vigentes.
La suma de los datos histológicos considerados como típicos de OR en las series más importantes que se han publicado hasta la fecha (9,12-16) aconseja que cualquier tumor oncocítico renal que muestre invasión del parénquima renal (fig. 15), invasión vascular (fig. 16), invasión de la grasa perinéfrica (fig. 17), encapsulación fibrosa e invasión de la cápsula (fig. 18), atipia nuclear (fig. 19), mitosis, binucleación o multinucleación (fig. 20), hemorragia (fig. 21), necrosis, patrón sólido o compacto de crecimiento (fig. 22), nucleolos evidentes, multifocalidad, aclaración citoplásmico fuera de la cicatriz central (fig. 23), bordes citoplásmicos mínimamente insinuados (fig. 24), o halos perinucleares incipientes o focales (fig. 25), debe ser considerado de entrada como atípico.
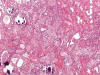
Fig. 15.
Tumor oncocitico atípico con características de
oncocitoma renal invadiendo el tejido renal y acompañándose de
microcalcificaciones (H&E, x250).

Fig. 16.
Invasión vascular en un tumor oncocítico atípico
(H&E, x100).
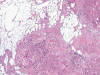
Fig. 17.
Invasión de la grasa perirenal en un tumor
oncítico atípico (H&E, x100).
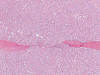
Fig. 18.
Cápsula e invasión capsular en un tumor
oncocítico atípico (H&E, x100).
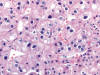
Fig. 19.
Anisomorfismo nuclear y halos perinucleaares
ocasionales en un tumor oncocítico atípico (H&E, x400).
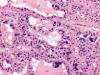
Fig. 20.
Atipia, hipercromatismo nuclear y multinucleación
en un tumor oncocítico atípico (H&E, x250).
Fig. 21.
Hemorragia y focos de necrosis en un área extensa
de un tumor oncocítico atípico (H&E, 100).
Fig. 22.
Patrón de crecimiento sólido con límites
citoplásmicos mal definidos en un tumor oncocítico atípico (H&E, x100).
Fig. 23.
Aclaramiento citoplásmico y binucleación fuera de
la cicatriz central en un tumor oncocítico atípico (H&E, x400).
Fig. 24.
Bordes citoplásmicos incipientes en un tumor
oncocítico atípico (H&E, x400).
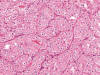
Fig. 25.
Halos claros perinucleares focales en un tumor
oncocítico atípico (H&E, x250).
Según Perez Ordoñez y cols (9), estos hallazgos atípicos no alteran el excelente pronóstico general de estos pacientes, ni predicen un comportamiento agresivo en todos ellos. Sin embargo, algunos comentarios de este mismo autor 10 años más tarde (5) inciden en la dificultad diagnóstica que entraña el problema. El propio título del trabajo, Renal oncocytoma, yet another tumour that does not fit in the dualistic benign/malignant paradigm? (5), resulta suficientemente elocuente. No obstante, los autores afirman que cualquier tumor renal que cumpla los criterios estrictos de OR debe ser diagnosticado como tal aunque pueda, eventualmente, compartir algunas características genéticas y moleculares con el CRCCr, e informan que la presencia de enfermedad metastásica no necesariamente implica una evolución clínica maligna ya que las metástasis pueden comportarse de una manera indolente, como se ha demostrado en dos casos bien documentados de OR con metástasis hepáticas (8,9).
En el otro lado del espectro, el CRCCr sufre la situación inversa, con situaciones clínicas inesperadamente indolentes, impropias de un carcinoma. No existen en la literatura estudios que pongan en relación determinados rasgos morfológicos con este comportamiento clínico. Como ya se ha comentado anteriormente en este trabajo, solamente la variante eosinofílica parece tener un mejor pronóstico (10), aunque existen aisladas discrepancias a este respecto (11).
El patrón inmunohistoquímico tampoco es definitorio y excluyente. A pesar de que se aconseja utilizar CD15, CK7 y CK20 en el diagnóstico diferencial entre ambos tumores (18), existen OR que muestran expresión focal de CK7, CRCC con inmunotinción de CK20, e incluso casos con expresión de ambos, o de ninguno de ellos.
Es conveniente señalar que la última palabra de estos tumores puede llegar a muy largo plazo, lo cual dificulta el seguimiento de los pacientes. Así, las metástasis de OR se han producido hasta 9 años después del diagnóstico en la pieza de resección quirúrgica (8) y las recurrencias de un CRCCh pueden aparecer hasta 10 años o más tras la cirugía (10).
Existen en la literatura casos mixtos de OR y de CRCCr (fig. 26), algunos de ellos mostrando transformación del primero en el segundo (30), o del primero en carcinoma papilar (31), así como oncocitosis renal (32,33) en el contexto del Síndrome de Birt-Hogg-Dubé, un proceso hamartomatoso de base genética que asocia fibrofoliculomas, pneumotórax espontáneos y tumores renales (34). Teniendo como punto de partida estos casos, diversos autores proponen la idea de la progresión neoplásica desde OR hasta CRCCr basándose en criterios morfológicos (35,36) y moleculares (30,33), y ello justificaría la existencia del tumor oncocítico atípico entendido como caso a medio camino entre los extremos. En este sentido, Nagashima y cols (32) estudian un caso de CRCCr con un diagnóstico de OR 19 años antes, en el contexto de una oncocitosis renal, lo cual habla de la progresión de la enfermedad y de la larga evolución de la progresión.
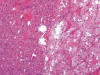
Fig. 26.
Tumor oncocítico híbrido mostrando áreas de
oncocitoma renal (izquierda) y de carcinoma renal de células cromófobas
(derecha) (H&E, x100).
CARCINOMA RENAL DE CÉLULAS CLARAS, VARIANTE DE CÉLULAS EOSINOFÍLICAS
El CCRCC constituye aproximadamente el 70% de los carcinomas renales en adultos y su pronóstico es sensiblemente peor que el de la mayoría de tumores renales convencionales (6). La inmensa mayor parte de los CCRCC están constituidos por células claras, de citoplasma ópticamente vacío y membranas citoplásmicas prominentes, que los hace muy característicos bajo el microscopio. Sin embargo, con gran frecuencia un pequeño porcentaje de las células del CCRCC presenta un citoplasma eosinofílico que no suele suponer un problema diagnóstico en el contexto general del tumor (24). El problema surge cuando este cambio eosinofílico de sus células pasa de ser minoritario a mayoritario, ya que esto puede llevar a considerar al CRCCr en el diagnóstico diferencial, y en este sentido, el trabajo de Abrahams y cols (24) sobre CRCCr es muy elocuente.
El término de carcinoma renal de células granulares fue muy utilizado en el pasado para referirse a muchos de estos tumores, pero es equivoco y está en desuso porque bajo ese término se incluían, además, algunos CRCCr de tipo eosinofílico y algunos carcinomas renales papilares de tipo 2. El confusionismo, como se puede comprobar, comienza por la propia terminología porque considera como «eosinofílicos y de aspecto granular» a subtipos histológicos de al menos tres tipos de tumores renales que son, como ha venido a demostrarse mediante estudios genéticos posteriores, entidades anatomo-clínicas totalmente diferentes.
Desde el punto de vista macroscópico esta variedad de CCRCC no difiere del convencional, mostrando masas sólidas o sólido-quísticas de color amarillento con áreas variables de necrosis y/o hemorragia. Histológicamente, muestran el patrón arquitectural y vascular típico. La células muestran citoplasmas eosinofílicos (fig. 27), aunque si el tumor se muestrea convenientemente siempre aparecen «células claras» características. En un trabajo reciente, Abrahams y cols (37) han encontrado que las células eosinofílicas presentan mayor grado de Fuhrman que las células claras dentro del mismo tumor.
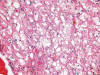
Fig. 27.
Carcinoma renal de células claras, variante
eosinofílica (H&E, x100).
Desde el punto de vista inmunohistoquímico (tabla 1) (18,19), ultraestructural (20), y genético (21) esta variante no difiere significativamente del CCRCC convencional.
El nivel de actividad y la expresión de peptidasas, determinados respectivamente por métodos fluorimétricos y por RT-PCR es, en nuestra experiencia (38), sensiblemente menor en el tejido tumoral respecto del tejido sano adyacente, mostrando en este sentido un patrón similar al observado en el OR y en el CRCCr.
CONCLUSIONES
Desde el punto de vista molecular, las neoplasias oncocíticas renales son un grupo de tumores en plena expansión y redefinición, y los próximos años probablemente serán testigos de cambios sustanciales en la concepción y en el diagnóstico de estos tumores. Sin embargo, hoy por hoy el patólogo asistencial de nuestros hospitales carece de criterios para diagnosticar de manera fiable y con las herramientas a su alcance, un porcentaje sustancial de estos tumores.
La experiencia acumulada demuestra que el comportamiento agresivo del OR diagnosticado siguiendo criterios histológicos estrictos puede ocurrir a largo plazo, tras muchos años de supuesta curación, lo cual sorprende al clínico, dificulta su seguimiento, y puede colocar al patólogo en una posición delicada frente al paciente y frente al clínico. Por otro lado, existe un número nada desdeñable de casos que cumplen sólo algunos de los criterios morfológicos o inmunohistoquímicos de OR, que tienden a ser diagnosticados como tales, pero que, siendo estrictos, están a medio camino entre el OR y el CRCCr.
Para no magnificar el problema y para ajustarlo a la realidad diaria de nuestros hospitales, hay que decir que la posibilidad de toparse con un tumor renal oncocítico es pequeña, pero real. Basándose en los criterios morfológicos recopilados en esta revisión, y siendo estricto con ellos, la mayoría de los tumores oncocíticos renales caerán o en el grupo de los OR o en el de los CRCCr. Sólo un porcentaje limitado de casos mostrará hallazgos incompletos, situándose a medio camino entre ambas entidades. Al objeto de evitar problemas, como patólogos, probablemente lo más correcto en este caso sea utilizar el término tumor oncocítico atípico, y dejar constancia en el informe que las neoplasias oncocíticas renales, al igual que ocurre con otros tumores en otras localizaciones, pueden tener un comportamiento biológico impredecible que es imposible de determinar con las herramientas actuales. El patólogo debe en estos casos aconsejar que todos estos pacientes sean seguidos clínicamente a largo plazo.
BIBILIOGRAFÍA
Zippel L. Understanding the oncocyte. Virchows Arch 1942; 308: 360-82.
Klein MJ, Valensi QJ. Proximal tubular adenomas of kidney with so-called oncocytic features. A clinicopathologic study of 13 cases of a rarely reported neoplasm. Cancer 1976; 38: 906-14.
Thoenes W, Störkel S, Rumpelt HJ. Human chromophobe cell renal carcinoma. Virchows Arch (B) 1985; 48: 207-17.
Thoenes W, Störkel S, Rumpelt HJ, et al. Chromophobe renal cell carcinoma and its variants. A report on 32 cases. J Pathol 1988; 155: 277-87.
van der Kwast T, Perez-Ordoñez B. Renal oncocytoma, yet another tumour that does not fit in the dualistic benign/malignant paradigm? J Clin Pathol 2007; 60: 585-6.
Lopez-Beltrán A, Scarpelli M, Montironi R, Kirkaly Z. 2004 WHO classification of the renal tumors of the adults. Eur Urol 2006; 49: 798-805.
Amin MB, Anthony P. Metastatic renal oncocytoma: a case report and review of the literature. Clinical Oncol 1999; 11: 277-9.
Oxley JD, Sullivan J, Mitchelmore A, Gillat DA. Metastatic renal oncocytoma. J Clin Pathol 2007; 60: 720-2.
Perez-Ordoñez B, Hamed G, Campbell S, Erlandson RA, Russo P, Gaugin PB, Reuter VE. Renal oncocytoma: A clinicopathologic study of 70 cases. Am J Surg Pathol 1997; 21: 871-83.
Onishi T, Oishi Y, Yanada S, Abe K, Hasegawa T, Maeda S. Prognostic implications of histological features in patients with chromophobe cell renal carcinoma. BJU Int 2002; 90: 529-32.
Peyromaure M, Misrai V, Thiounn N, et al. Chromophobe renal cell carcinoma. Analysis of 61 cases. Cancer 2004; 100: 1406-10.
Davis CJ, Sesterhenn IA, Mostofi FK, et al. Renal oncocytoma: Clinicoapthological study of 166 patients. J Urogenital Pathol 1991; 1: 41-52.
Amin MB, Tickoo SK, Farrow GM. Renal oncocytoma: A reappraisal of morphologic features with clinicopathologic findings in 80 cases. Am J Surg Pathol 1997; 21: 1-12.
Dechet CB, Bostwick DG, Blute ML, et al. Renal oncocytoma: multifocality, bilateralism, metachronous tumor development and coexistent renal cell carcinoma. J Urol 1999; 162: 40-2.
Romis L, Cindolo L, Patard JJ, et al. Frequency, clinical presentation and evolution of renal oncocytomas: Multicentric experience from a ignatur database. Eur Urol 2004; 45: 53-7.
Gudbjartsson T, Hardarson S, Petursdottir V, Thoroddsen A, Magnusson J, Einarsson GV. Renal oncocytoma: A clinicopathological analysis of 45 consecutive cases. BJU Int 2005; 96: 1275-9.
Lopez JI, Fernández de Larrinoa A, Zabala R, Oleaga L, del Cura JL, Bilbao FJ. Utilidad de la biopsia cilindro guiada por control ecográfico en el diagnóstico y manejo de los tumores renales. Rev Esp Patol 2006; 39: 219-27.
Zhou M, Roma A, Magi-Galluzzi C. The usefulness of immunohistochemical markers in the differential diagnosis of renal neoplasms. Clin Lab Med 2005; 25: 247-57.
Liu L, Qian J, Singh H, Meiers I, Zhou X, Bostwick DG. Immunohistochemical analysis of chromophobe renal cell carcinoma, renal oncocytoma, and clear cell carcinoma. An optimal and practical panel for differential diagnosis. Arch Pathol Lab Med 2007; 131: 1290-7.
Rodriguez Gil Y, Martinez Gonzalez MA, Montes Moreno S, Ortega Serrano MP, Usera Sárraga G. Ultraestructura de los tumores epiteliales renales. Rev Esp Patol 2007; 40: 171-81.
Meloni-Ehrig A. Renal cancer: Cytogenetic and molecular genetic aspects. Am J Med Genet 2002; 115: 164-72.
Baiyee D, Banner B. Mismatch repair genes in renal cortical neoplasms. Hum Pathol 2006; 37: 185-9.
Nagashima Y.Chromophobe renal cell carcinoma: Clinical, pathological and molecular biological aspects. Pathol Int 2000; 50: 872-8.
Abrahams NA, MacLennan GT, Khoury JD, et al. Chromophobe renal cell carcinoma: A comparative study of histological, immunohistochemical and ultrastructural features using high throughput tissue microarray. Histopathology 2004; 45: 593-602.
Nagashima Y, Okudela K, Osawa A, et al. Chromophobe renal cell carcinoma with sarcomatoid change. A case report. Pathol Res Pract 2000; 196: 647-51.
Cindolo L, de la Taille A, Schips L, et al. Chromophobe renal cell carcinoma: Comprehensive analysis of 104 cases from multicenter European database. Urology 2005; 65: 681-6.
Cheville JC, Lohse CM, Zincke H, Weaver AL, Blute ML. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 2003; 27: 612-24.
Tickoo SK, Lee MW, Eble JN, et al. Ultrastructural observations on mitochondria and microvesicles in renal oncocytoma, chromophobe renal cell carcinoma, and eosinophilic variant of conventional (clear cell) rnela cell carcinoma. Am J Surg Pathol 2000; 24: 1247-56.
Brunelli M, Eble JN, Zhang S, Martignoni G, Delahunt B, Cheng L. Eosinophilic and classic chromophobe renal cell carcinomas hava similar frequent losses of multiple chromosomes from among chromosomes 1, 2, 6, 10, and 17, and this pattern of genetic abnormality is not present in renal oncocytoma. Mod Pathol 2005; 18: 161-9.
Salido M, Lloreta J, Melero C, et al. Insertion (8;11) in a renal oncocytoma with multifocal transformation to chromophobe renal cell carcinoma. Cancer Genet Cytogenet 2005; 163: 160-3.
Al-Saleem T, Balsara BR, Liu Z, et al. Renal oncocytoma with loss of chromosomes Y and 1 evolving to papillary carcinoma in conection with gain of chromosome 7. Coincidence or progression? Cancer Genet Cytogenet 2005; 163: 81-5.
Nagashima Y, Mitsuya T, Shioi K, et al. Renal oncocytosis. Pathol Int 2005; 55: 210-5.
Al-Saleem T, Cairns P, Dulaimi EA, Feder M, Testa JR, Uzzo RG. The genetics of renal oncocytosis: a possible model for neoplastic progression. Cancer Genet Cytogenet 2004; 152: 23-8.
Pavlovich CP, Walther MM, Eyler RA, et al. Renal tumors in the Birt-Hogg-Dubé syndrome. Am J Surg Pathol 2002; 26: 1542-52.
Tickoo SK, Amin MB, Zarbo RJ. Colloidal iron staining in renal epithelial neoplasms, including chromophobe renal cell carcinoma: emphasis on technique and patterns of staining. Am J Surg Pathol 1998; 22: 419-24.
Mai KT, Dhamanaskar P, Belanger E, Stinson WA. Hybrid chromophobe renal cell neoplasm. Pathol Res Pract 2005; 201: 385-9.
Abrahams N, Slaton JW, Wood, et al. Eosinophilic cells in conventional renal cell carcinoma: observations in 100 cases and implications for Fuhrman nuclear grading. Mod Pathol 2003; 16: 628A.
Varona A, Blanco L, López JI, et al. Altered levels of acid, basic, and neutral peptidase activity and expression in human clear cell renal cell carcinoma. Am J Physiol Renal Physiol 2007; 292: F780-8.