
Vol. 41, n.º 3, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 3, 2008 |
CASUÍSTICA
Natalia Camarasa Lillo1, Esther Roselló Sastre1, Alberto Palmeiro Uriach2, Mónica García Cosío-Piqueras3, Almudena Santón Roldán3, Andrés Beiras4, Jerónimo Forteza Vila4
1 Hospital
Universitario Doctor Peset. Avda. Gaspar Aguilar, 90. 46017 Valencia.
2 Hospital Río Carrión, Palencia.
3 Hospital Universitario Ramón y Cajal, Madrid.
4 Hospital Clínico Universitario de Santiago de Compostela, La
Coruña.
ncamarasalillo@gmail.com
RESUMEN
Introducción: El Sarcoma histiocítico (SH) es una neoplasia muy poco frecuente, con mucha controversia respecto a los criterios diagnósticos de esta entidad. Desde que las técnicas inmunohistoquímicas y citogenéticas presentan una mayor disponibilidad universal, muchos casos que inicialmente se diagnosticaron como sarcoma histiocítico, han sido reclasificados como otras enfermedades. Presentación del caso: Describimos el caso de un sarcoma histiocítico que se presentó como una masa abdominal. En la autopsia también se observó afectación tumoral de pulmones, hígado, bazo y múltiples adenopatías. El examen histológico mostró proliferación difusa de células grandes con áreas de necrosis. Las células malignas eran de aspecto histiocitario y pleomórficas. Inmunohistoquímicamente, las células tumorales fueron positivas para tinciones contra marcadores histiocíticos y negativas para marcadores mieloides, dendríticos, CD30, ALK1, y otros marcadores linfoides. En el estudio ultraestructural las células mostraron extensiones citoplásmicas interdigitantes, pero no gránulos de Birbeck. Conclusiones: El sarcoma histiocítico plantea diagnóstico diferencial con otras neoplasias. El diagnóstico en este caso, se basa en la morfología, técnicas inmunohistoquícas y ultraestructurales.
Palabras clave: Sarcoma histiocítico; sarcoma de células dendríticas interdigitantes.
SUMMARY
Introduction: Histiocytic sarcoma (HS) is a rare disease. There has been much confusion concerning the diagnostic criteria for this entity. Since immunohistochemical and cytogenetic techniques have become more universally available, many cases that were initially diagnosed as histiocytic sarcoma are now being classified as other diseases. Case presentation: We describe a case of HS that began as abdominal mass. At autopsy the tumour also involved lungs, liver, spleen and multiple lymph nodes. Histological examination showed proliferation of numerous large histiocytic pleomorphic and malignant cells with areas of necrosis. Immunohistochemically, tumour cells expressed histiocytic markers but did not stain with antibodies directed against myeloid markers, dendritic markers, CD30, ALK1, or other lymphoid markers. Ultrastructural examination demostrated interdigitating cytoplasmic extensions, but not Birbeck granules. Conclusions: Histiocytic sarcoma raises differential diagnosis with other neoplasms. In this case, morphological, immunohistochemical and ultraestructural findings are necessary for diagnosis.
Keywords: Histiocytic sarcoma; interdigitating dendritic cell sarcoma.
INTRODUCCIÓN
Previamente al desarrollo de la inmunohistoquímica y de la biología molecular, el diagnóstico de «linfoma histiocítico» se ha utilizado para todas aquellas neoplasias hematolinfoides de células redondas que mostraban amplio citoplasma y núcleos irregulares (1). La mayoría de casos publicados inicialmente como linfomas histiocíticos corresponden, tras estudio inmunohistoquímico, a linfomas de células B o T, especialmente linfomas anaplásicos de célula grande, por lo que el término cayó en desuso (2). Sin embargo, la OMS, en su última clasificación conserva el término de sarcomas histiocíticos verdaderos para casos muy concretos (3,4). Son neoplasias malignas de precursores histiocíticos que habitualmente afectan a piel, ganglios linfáticos, tracto gastrointestinal y partes blandas (3). Son neoplasias muy poco frecuentes representadas en la literatura por casos únicos y series muy cortas. Hay un amplio rango de edad de afectación, que abarca desde niños a adultos, sin embargo, la mayoría de casos se dan en adultos (media de edad de 46 años) con predilección por varones. El pronóstico es nefasto, presentándose en su mayoría como estadios de enfermedad muy avanzados (5). El diagnóstico combina las características morfológicas con adecuados marcadores inmunohistoquímicos: positividad de marcadores histiocitarios (CD68, lisozima) junto con ausencia de marcadores de células T, B, células mieloides y células histiocíticas diferenciadas (células de Langerhans, células dendríticas foliculares y células dendríticas interdigitantes) (6).
PRESENTACIÓN DEL CASO
Se trata de un varón de 76 años con historia clínica de masa abdominal, fiebre y síndrome constitucional. Fue intervenido por un cuadro de suboclusión intestinal con diagnóstico anatomopatológico de adenocarcinoma de colon moderadamente diferenciado (5,5 cm) con infiltración de grasa pericólica adyacente y metástasis de 3 ganglios linfáticos (pT3N1). Además de la pieza intestinal, se remitió un «ganglio linfático de raíz mesentérica» de 1 cm de diámetro máximo que histológicamente era un nódulo linfoide, en el que no se reconocía la arquitectura ganglionar, ocupado por una proliferación difusa de células grandes no cohesivas, con núcleo vesicular pleomórfico, nucléolo prominente y amplio citoplasma eosinófilo (fig. 1). Dichas células se disponían entre un denso infiltrado inflamatorio a base de neutrófilos, linfocitos y células plasmáticas. La lesión correspondía a una neoplasia con morfología histiocítica clara (fig. 2) de estirpe hematolinfoide positiva para LCA (CD45) (fig. 3), y que mostraba positividad intensa para CD68 (fig. 4) y S-100 (fig. 5), combinado con negatividad para marcadores de células T y B, marcadores mieloides, CD30, ALK1, células de Langerhans (CD1a) y células dendríticas (CD21). Otros marcadores como CD35, HMB-45 y keratinas fueron negativos. El diagnóstico fue de sarcoma histiocítico.
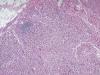
Fig. 1:
Panorámica de la masa tumoral (H&E 40x).
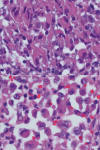
Fig. 2:
Detalle de células tumorales con hábito histiocitoide (H&E 600x).

Fig. 3:
Células tumorales mostrando intensa positividad con CD45 (600x).

Fig. 4:
Intensa inmunotinción citoplásmica con CD68 (600x).
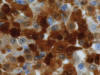
Fig. 5:
Células histiocitarias mostrando gran positividad con S-100 (600X).
El paciente falleció 28 días después de la intervención. En el estudio necrópsico se evidenciaba una masa tumoral multinodular, dependiente de mesenterio, sólida, blanca y firme, que medía 22 x 17 x 15 cm (fig. 6). Dicha masa estaba adherida a cuerpos vertebrales lumbares y rodeaba vasos abdominales principales, rechazando órganos y vísceras adyacentes sin infiltrarlos macroscópicamente. Sobre la superficie tumoral se reconocía el lugar donde se resecó previamente el «ganglio de raíz de meso». Además, tenía múltiples nódulos de iguales características a los de la masa principal, en hígado (fig. 7), pulmones y bazo, así como adenopatías retroperitoneales, mediastínicas, supraclaviculares y axilares. Las masas y nódulos tumorales hallados en la autopsia presentaron iguales características histológicas (a excepción de áreas de necrosis masiva) y mismo perfil inmunohistoquímico que los descritas previamente en el «ganglio linfático de raíz mesentérica».
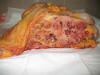
Fig. 6:
Estudio necrópsico: Masa tumoral en un corte transversal del paquete abdominal a
nivel del polo inferior renal derecho.

Fig. 7:
Nódulos metastáticos en cortes transversales hepáticos.
Se rescató material necrópsico (recuperado del formol) de uno de los nódulos pulmonares para estudio ultraestructural. En el estudio con microscopía electrónica se confirmó la naturaleza histiocitaria de las células tumorales (fig. 8), y se identificaron procesos celulares interdigitantes. No se observaron gránulos de Birbeck.

Fig. 8:
Microscopía electrónica: célula dendrítica con procesos celulares
interdigitantes.
DISCUSIÓN
Las neoplasias de células histiocitarias y dendríticas derivan del sistema mononuclear fagocitario y células accesorias, las cuales desempeñan su principal papel en el procesamiento y presentación de antígenos a los linfocitos (7). Las células dendríticas o células presentadoras de antígeno, se distribuyen en muchos tejidos del organismo. A las ubicadas en los centros foliculares linfoides, se las denomina células dendríticas foliculares. Dichas células presentan inmunotinción para CD21, CD23 y CD35, pero son CD45 negativas (8). En el estudio ultraestructural, la característica más llamativa es la presencia de abundantes y largos procesos citoplásmicos conectados mediante desmosomas (8). Cuando las células dendríticas ganglionares se localizan fuera del centro germinal, son referidas como células reticulares interdigitantes, las cuales son intensamente positivas para la proteína S-100 y para vimentina (9). Ultraestructuralmente, estas células muestran complejos procesos celulares interdigitantes, sin claras uniones desmosómicas. Las células de Langerhans son un subtipo de células presentadoras de antígeno localizadas predominantemente en la piel, pero también en otros órganos (10). Sus características principales son el inmunofenotipo positivo para CD1a y la identificación de gránulos de Birbeck en el microscopio electrónico. Entre las células procesadoras de antígeno o fagocitos, tenemos a los histiocitos, con un inmunofenotipo que expresa intensa tinción para CD68 y lisozima (11). El estudio ultraestructural de estas células muestra amplios citoplasmas con abundantes lisosomas, ausencia de gránulos de Birbeck y de uniones celulares (11).
El diagnóstico de los tumores histiocitarios y de células dendríticas no puede ser dilucidado únicamente de la información clínica, como ocurre en la mayor parte del diagnóstico en hematopatología. Microscópicamente, estos tumores abarcan un amplio espectro de características histológicas, con patrones epitelioides, fusocelulares, de células redondas indiferenciadas, o con gran acompañamiento inflamatorio que enmascara la población tumoral, por lo que la inmunohistoquímica (CD68, CD21, CD23, CD35, CD1a y S-100) (8) y la microscopía electrónica son esenciales para llegar al diagnóstico (tabla 1).

El diagnóstico diferencial morfológico del sarcoma histiocítico incluye pseudotumor inflamatorio, sarcoma folicular de células dendríticas, sarcoma de células dendríticas interdigitantes, histiocitosis maligna de células de Langerhans, linfoma anaplásico de célula grande, melanoma y otros sarcomas (9). En nuestro caso, la marcada inmunorreactividad de las células tumorales para marcadores histiocitarios (CD68 y Lisozima) y para CD45 (LCA), asociado a la falta de expresión de marcadores de células T y B y de ALK, apoyaron el diagnóstico de sarcoma histiocítico, frente a linfomas, melanoma y otro tipo de sarcomas. Además, la positividad de S-100 fue intensa, lo cual apoya el diagnóstico de los sarcomas de células dendríticas, que concuerda con la negatividad para CD1a, CD21 y CD35. Los sarcomas histiocíticos presentan idéntica inmunohistoquímica que los sarcomas de células dendríticas interdigitantes, pero sin o con positividad débil para S-100.
Además, el estudio ultraestructural fue acorde con células dendríticas interdigitantes, demostrando la presencia de procesos celulares interdigitantes en algunas células. El inmunofenotipo de las células tumorales presentó características combinadas de sarcoma histiocítico y de células dendríticas interdigitantes, llegándose al diagnóstico de sarcoma histiocítico con rasgos de células dendríticas interdigitantes (12).
El pronóstico de los sarcomas histiocíticos y de células dendríticas interdigitantes es nefasto (13). Hasta la fecha, no se ha llegado a un consenso sobre el régimen quimioterápico estándar a seguir en este grupo de pacientes. Se ha usado quimioterapia de linfomas no-Hodgkin, con respuestas variables al tratamiento, pero sin obtener resultados favorables en la mayoría de los casos. Se ha probado tratamiento, también sin éxito, con poliquimioterapia incluyendo doxorubicina, ciclofosfamida, vincristina y prednisona. Hay un caso descrito en el que se obtuvo mejoría tras régimen quimioterápico con ABVD (adriamicina, bleomicina, vinblastina, dacarbacina) (14). Es decir, son tumores con conducta muy agresiva, y con respuesta quimioterápica variable y poco establecida.
En la literatura hay dos casos publicados de sarcoma de células dendríticas interdigitantes con carcinoma coexistente (15,16), al igual que en nuestro paciente, que presentaba adenocarcinoma de colon (no dependiente del sarcoma histiocítico descrito).
BIBLIOGRAFÍA
Rappaport H, editor. Tumors of the hematopoietic system. Atlas of Tumor Pathology. Washington, DC: AFIP; 1996.
Sun W, Nordberg ML, Fowler MR. Histiocytic sarcoma involving the central nervous system: clinical, immunohistochemical, and molecular genetic studies of a case of review of the literature. Am J Surg Pathol 2003; 27: 258-65.
Kairouz S, Hashash J, Kabbara W, McHayleh W, Tabbara IA. Dendritic cell neoplasms: an overview. Am J Hematol 2007; 82: 924-8.
Elaine s Jaffe, Nancy Lee Harris, Harald Stein, James W Vardiman, editores. Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. Capítulo 10. Lyon: World Health Organization Classification of tumours; 2001.
Cao M, Eshoa C, Schultz C, Black J, Zu Y, Chang CC. Primary central nervous system histyocitic sarcoma with relapse to mediastinum: a case report and review of the literature. Arch Pathol Lab Med 2007; 131: 301-5.
Lauritzen AF, Delsol G, Hansen NE, Horn T, Ersbøll J, Hou-Jensen K, Ralfkiaer E. Histiocytic sarcomas and monoblastic leukemias. A clinical, histologic, and immunophenotypical study. Am J Clin Pathol 1994; 102: 45-54.
Hornick JL, Jaffe ES, Fletcher CD. Extranodal histiocytic sarcoma: clinicopathologic analysis of 14 cases of a rare epithelioid malignancy. Am J Surg Pathol 2004; 28: 1133-44.
Grogg KL, Lae ME, Kurtin PJ, Macon WR. Clusterin expression distinguishes follicular dendritic cell tumors from other dendritic cell neoplasms: report of a novel follicular dendritic cell marker and clinicopathologic data on 12 additional follicular dendritic cell tumors and 6 additional interdigitating dendritic cell tumors. Am J Surg Pathol 2004; 28: 988-98.
Ylagan LR, Bartlett NL, Kraus M. Interdigitating dendritic reticulum cell tumor of lymph nodes: case report with differential diagnostic considerations. Diagn Cytopathol 2003; 28: 278-81.
Kairouz S, Hashash J, Kabbara W, McHayleh W, Tabbara IA. Dendritic cell neoplasms: an overview. Am J Hematol 2007; 82: 924-8.
Osborne BM, Mackay B. True histiocytic lymphoma with multiple skin nodules. Ultrastruct Pathol 1994; 18: 241-6.
Porter DW, Gupte GL, Brown RM, Spray C, English MW, deVille DeGoyet J, MacKiernan PJ. Histiocytic sarcoma with interdigitating dendritic cell differentiation. J Pediatr Hematol Oncol 2004; 26: 827-30.
Kanaan H, Al-Maghrabi J, Linjawi A, Al-Abbasi A, Dandan A, Haider AR. Interdigitating dendritic cell sarcoma of the duodenum with rapidly fatal course: a case report and review of the literature. Arch Pathol Lab Med 2006; 130: 205-8.
Olnes MJ, Nicol T, Duncan M, Bohlman M, Erlich R. Interdigitating dendritic cell sarcoma: a rare malignancy responsive to ABVD chemotherapy. Leuk Lymphoma 2002; 43: 817-21.
Nakamura S, Koshikawa T, Kitoh K, Nakayama A, Imai Y, Ishii K, et al. Interdigitating cell sarcoma: a morphologic and immunologic study of lymph node lesions in four cases Pathol Int 1994; 44: 374-86.
Alvaro T, Bosch R, Salvadó MT, Piris MA. True histiocytic lymphoma of the stomach associated with low grade B cell mucosa associated lymphoid tissue (MALT)-type lymphoma. Am J Surg Pathol 1996; 20: 1406-11.