
Vol. 41, n.º 2, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 2, 2008 |
CASUÍSTICA
Fátima Agüero Zaputovich, Lidia Cardozo, Beatriz Di Martino, Gloria Valdovinos, Mirtha Rodríguez Masi, Oilda Knopfelmacher, Lourdes Bolla
Cátedra de Dermatología. Hospital de Clínicas.
Asunción, Paraguay.
beatrizdimartino@gmail.com
RESUMEN
La Paracoccidioidomicosis es la micosis profunda sistémica más frecuente en América Latina, causada por el hongo dimórfico Paracoccidioides brasiliensis. La forma clínica más frecuente es la crónica multifocal con afectación pulmonar y muco-cutánea. Con la diseminación del VIH el diagnóstico de paracoccidioidomicosis debe tenerse en cuenta particularmente en áreas endémicas. Las manifestaciones cutáneas en esta última son muy frecuentes; más del 90% de pacientes las presentan en alguna fase de la evolución. Se presenta el caso de un varón adulto joven HIV + con paracoccidioidomicosis crónica multifocal.
Palabras clave: Paracoccidioidomicosis, HIV, SIDA, inmunodepresión.
SUMMARY
Paracoccidioidomycosis is the most frequent deep mycosis in Latin America, caused by the dimorphic fungus Paracoccidioides brasiliensis. The most frequent clinical form is the chronic multifocal with pulmonary and muco-cutaneous affectation. With the dissemination of the VIH the paracoccidioidomycosis diagnosis must be consider particularly in endemic areas. The cutaneous manifestations in this last one are very frequent; more of 90% of patients present them in any phase of the evolution of the disease. We present the case of an adult young man young HIV + with multifocal chronic paracoccidioidomycosis.
Keywords: Paracoccidioidomycosis, HIV, AIDS, immunosupression.
INTRODUCCIÓN
La paracoccidiodomicosis es una micosis profunda subaguda y crónica granulomatosa causada por el hongo dimórfico Paracoccidioides brasiliensis. Es de naturaleza geofílica, de suelos ácidos y boscosos, habitando climas húmedos de veranos lluviosos e inviernos cortos, características ambientales encontradas en nuestro país (2).
Es endémica en Latinoamérica, desde México hasta Argentina, frecuente en adultos jóvenes masculinos (relación 9:1) provenientes de áreas rurales, lo que es atribuido a la mayor exposición laboral del hombre al hábitat del hongo y al papel protector de los estrógenos en las mujeres, ya que esta hormona femenina inhibe la transición de la fase micelial a la levaduriforme patógena (3).
Se reconocen dos formas clínicas principales de la enfermedad; una forma aguda y subaguda, y una forma crónica uni y multifocal. La forma aguda se observa en jóvenes de ambos sexos, afectando principalmente al sistema reticuloendotelial, mientras que la forma crónica, mas frecuente en varones adultos, se presenta con gran comprometimiento pulmonar y/o lesiones muco-cutáneas, caracterizadas por su gran polimorfismo, siendo patognomónica la estomatitis moriforme descripta por Aguiar Puppo (4).
Con la diseminación del VIH el diagnóstico de paracoccidioidomicosis debe tenerse en cuenta particularmente en áreas endémicas. Sin embargo, el número de casos reportados en asociación con dicha afección continúa siendo pequeño (1).
DESCRIPCIÓN DEL CASO CLÍNICO
Paciente varón de 30 años de edad, eutrófico, heterosexual promiscuo, procedente de un medio urbano, conocido portador de HIV desde hace 4 meses en tratamiento antirretroviral. Niega antecedentes de alcoholismo y tabaquismo.
Consulta por múltiples lesiones asintomáticas que se inician hace 3 meses como placas eritematovioláceas redondeadas de bordes sobreelevados con centros hiperqueratósicos y ulcerocostrosos, de 0,5-2 cm de diámetro localizadas en rostro, antebrazos, abdomen y pierna izquierda. Adenomegalias laterocervicales (figs. 1 y 2).
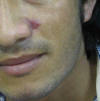
Fig. 1:
Clínica. Placa eritematoviolácea, ovoide, de 0,9
x 0,6 cm de diámetros mayores, de superficie escamosa en surco nasogeniano. Se
aprecia además adenomegalia laterocervical izquierda.
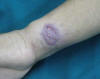
Fig. 2:
Clínica. Se observa una placa eritematoviolácea
redondeada, de 2 x 1,5 cm de diámetros, con bordes sobreelevados y centro
ulcerocostroso en antebrazo izquierdo.
La analítica arrojó los siguientes datos: hemoglobina: 9,9 mg %, leucocitos 9000 cel/mm3, VSG 40 mm/1.ª hora, VDRL no reactiva, HIV positivo (elisa), CD4 112 cel/mm3.
Radiografía de tórax normal. No se pudo realizar un BAL.
Examen micológico directo y cultivo: Se aísla Paracoccidioides brasiliensis.
Se realizaron una biopsia cutánea y otra de adenopatía cervical.
El paciente fue tratado con itraconazol 200 mg/día, y fue evaluado a los 15 días de iniciado el tratamiento, presentando buena respuesta terapéutica.
ESTUDIO HISTOPATOLÓGICO
Se remiten para estudio anatomopatológico, fijada en formol al 10%, una biopsia cutánea efectuada por medio de un cilindro de 0,3 cm de eje mayor y un fragmento irregular de tejido de 1,7 x 1,5 x 0,9 cm procedente de ganglio cervical.
La biopsia cutánea realizada de los márgenes de la lesión ulcerada, presentaba epidermis con hiperplasia pseudoepiteliomatosa, observándose en la dermis un proceso inflamatorio crónico granulomatoso supurativo con abundantes células gigantes multinucleadas apreciándose en sus citoplasmas estructuras redondeadas de tamaño variable, con refuerzo periférico de la membrana y algunas yemas externas correspondientes a estructuras micóticas (imágenes características en ratón Miguelito).
El parénquima ganglionar se hallaba masivamente reemplazado por un proceso inflamatorio de iguales características a las descriptas en la biopsia cutánea (figs. 3 y 4).

Fig. 3:
Histopatología del ganglio linfático cervical. Se
observa tejido linfoide masivamente sustituido por un proceso inflamatorio
crónico granulomatoso, con granulomas confluentes centrados por áreas de
necrosis coagulativa (Hematoxilina 4x).
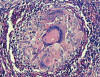
Fig. 4:
Histopatología cutánea. En dermis reticular se
observa un granuloma epitelioide bien constituido, con abundantes células
gigantes multinucleadas, observándose en el interior de una de ellas la
estructura micótica característica con dos yemas, dando la imagen en ratón
Miguelito (Hematoxilina 40x).
DISCUSIÓN
La Paracoccidioidomicosis es la micosis profunda sistémica más frecuente en América Latina. La forma clínica predominante es la crónica multifocal, viéndose en la mayoría de los casos la asociación cutáneo-mucosa y pulmonar (11).
El amplio rango de formas clínicas está determinado por las características de la relación huésped-parásito. Los factores importantes de parte del hongo son número y tipo de conidias que penetran durante la infección. Las blastoconidias son más virulentas que las artroconidias; los a 1-3 glucanos en las paredes celulares incrementan la patogenicidad y algunos polisacáridos de estas paredes pueden activar linfocitos CD8 capaces de inhibir la respuesta inmune. Son factores predisponentes dependientes del paciente la depresión inmunitaria (inmunidad celular), desnutrición, alcoholismo, factores hormonales (estrógenos) y genéticos (HLA-A9, HLA-B13, HLA-B40).
En los individuos inmunocompetentes las defensas innatas o adquiridas eliminan a Paracoccidioides brasiliensis o establecen un equilibrio entre el hongo y el huésped, lo que permite al hongo permanecer viable mediante la formación de focos latentes de infección. La coexistencia de la paracoccidioidomicosis y el SIDA en la misma área geográfica debería revelar la coexistencia de ambas enfermedades como un evento común, tal y como sucede con la histoplasmosis y la coccidioidomicosis (5,6).
Las micosis profundas sistémicas y oportunistas son patologías que han incrementado su frecuencia en pacientes inmunosuprimidos en los últimos años, especialmente por la aparición del VIH, agente causal del SIDA (7).
Sin embargo, hay muy pocos casos reportados a nivel internacional (menos de 50 casos), en los 10 años siguientes a la descripción de los primeros pacientes (8), estimándose la incidencia de esta asociación en alrededor de 0,09%, afectando a individuos con grave inmunosupresión con cuentas de CD4 menores a 200 células/mm3 (8).
Existen varias teorías que tratan de explicar la escasa incidencia. Una de ellas se refiere al uso del cotrimoxazol en el tratamiento y prevención de la neumonía causada por P. carinii, ya que esta droga también es efectiva contra P. brasiliensis, y otra al uso de compuestos azólicos contra la candidosis u otras infecciones micóticas. Una razón adicional es la alta prevalencia de la infección por el VIH en las zonas urbanas, y a que P. brasiliensis es más común en los ambientes rurales. Aún a pesar de la existencia de estas teorías, ninguna de ellas explica el diagnóstico reducido de esta micosis en los pacientes con SIDA (5-8).
La leishmaniasis muco cutánea es quizás la principal enfermedad que debe tenerse en cuenta en el diagnóstico diferencial por las manifestaciones cutáneo-mucosas con presencia de lesiones ulcerativas y granulomatosas parecidas. Pese a que la leishmaniasis es más destructiva con tendencia hipertrófica, la enfermedad presenta localización semejante y hay coincidencia en áreas endémicas. Las lesiones verrugoides, ulcerativas o vegetativas sugieren esporotricosis o leishmaniasis cutánea secundaria (9,10).
El diagnóstico diferencial histopatológico debe establecerse con otras micosis profundas que se presentan con granulomas epitelioides supurativos y esférulas micóticas con gemación externa:
– Blastomicosis norteamericana: cuyas características histológicas son comunes a la cromomicosis y esporotricosis. Existe hiperplasia epitelial pseudoepiteliomatosa con infiltrado inflamatorio dérmico constituido por granulomas escasamente formados y otros supurantes. Las levaduras son esféricas y pueden poseer un brote único. Esta infección solo ocurre en América del Norte y en partes de África.
– Coccidioidomicosis: caracterizada por granulomas no caseificantes en dermis con hiperplasia pseudoepiteliomatosa superpuesta en epidermis. Las esférulas del hongo son de gran tamaño a veces midiendo hasta 80 µ.
– Histoplasmosis: caracterizada por un infiltrado dérmico granulomatoso, con numerosos macrófagos parasitados por estructuras ovoides de pequeño tamaño rodeadas de halo claro.
Debido al gran polimorfismo de lesiones que puede presentar esta enfermedad, los médicos trabajadores de áreas endémicas deben estar alerta de su presencia y tenerla en cuenta como una de las infecciones oportunistas ante individuos portadores de HIV ya que un diagnóstico y tratamiento oportunos con antimicóticos triazólicos y terapia antirretroviral derivan en una rápida mejoría del cuadro y mejoran notablemente la sobrevida (7).
Es importante tener en cuenta que los pacientes con infección por el VIH y con paracoccidioidomicosis pueden tener bajos niveles de producción de anticuerpos y paracoccidioidina negativa, por lo tanto, estas pruebas deben ser acompañadas en la medida de las posibilidades de estudio histopatológico y cultivo para la identificación de los agentes causales (5,7).
Motiva la presentación del caso la asociación relativamente poco frecuente de las dos afecciones, paracoccidioidomicosis multifocal en un paciente inmunodeprimido HIV positivo, proveniente de un área rural endémica.
BIBLIOGRAFÍA
Negroni R. Paracoccidiodomicosis. En: Torres Rodríguez JM, ed. Micología Médica. Barcelona: Masson, 1993: 263-73.
Arenas R. Paracoccidioidomicosis. En: Micología médica ilustrada. Interamericana McGraw-Hill, México 2004: 173-9.
Giménez MF. Consideraciones epidemiológicas de la paracoccidioidomicosis en un área endémica del nordeste argentino. Tesis doctorado en Medicina. Buenos Aires, Argentina: Universidad de Buenos Aires; 1986.
Manns BJ, Baylis BW, Urbanski SJ, Gibb AP, Rabin HR. Paracoccidioidomycosis: case report and review. Clin Infect Dis 1996, 23: 1026-32.
Dolande M, Reviákina V, Panizo M, Maldonado B. Diagnóstico inmunológico de las micosis sistémicas en pacientes con SIDA (1997-2001). Rev Soc Ven Microbiol 2002; 22: 51-6.
Birman E, Silveira F, Godoy L, Costa C. Kaposi’s sarcoma in Brazilian AIDS patients: a study of 144 cases. Pesqui Odontol Bras. 2000; 14: 362-6.
Lacaz CS. Paracoccidioidomycosis in HIV patients. Case report. Int Conf AIDS. 1996; 11: 95.
Corti M, Villafañe M, Negroni R, Palmieri O. Disseminated paracoccidioidomycosis with peripleuritis in an AIDS patient. Rev Inst Med Trop.2004: . Rev. Inst. Med. trop. S. Paulo 2004; 46:47-50.
Colombo A, Camargo L, Fischman O y Castelo A. Parámetros clínicos relevantes para o diagnóstico diferencial entre leshmaniose cutáneo-mucosa e paracoccidioidomicose. Rev Soc Bras Med Trop 1992; 25: 171-5.
Marques SA, Marques MEA, Travessa MA, Castro CVB, Camargo RMP. Paracoccidioidomicosis de mama simulando neoplasia. Uruguay: Anais XVII Reunión Anual de Dermatólogos Latinoamericanos del Cono Sur. Montevideo 1996; 60: 1.
Rodriguez Masi M. Estudio Clínico y Epidemiológico de la Paracoccidioidomicosis y otras micosis profundas en la Cátedra de Dermatología del Hospital de Clínicas. Periodo 1992-2002. Tesis doctorado en Medicina. Asunción, Paraguay: Universidad Nacional de Asunción; 2003.