
Vol. 41, n.º 1, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 1, 2008 |
REVISIONES
Josep Lloreta Trull
Servicio de Anatomía Patológica. Hospital del
Mar. Universitat Pompeu Fabra. Barcelona.
jlloreta@imas.imim.es
RESUMEN
El microscopio electrónico aporta información detallada sobre la estructura de las células y los tejidos, así como sobre las variaciones funcionales que experimentan en situaciones normales y patológicas. Estos datos tienen una traducción directa en el aspecto de esas mismas células en las secciones histológicas convencionales. En este artículo, se revisan las principales características ópticas del citoplasma, del núcleo y de la matriz extracelular y se correlacionan con los rasgos ultraestructurales subyacentes. Conocer el substrato ultraestructural puede ser de gran utilidad para conseguir que la información que se obtiene con el microscopio óptico sea más cuantiosa y más precisa.
Palabras clave: Microscopía electrónica, células claras, células rabdoides, células granulares, células espumosas.
SUMMARY
The electron microscope provides detailed information on cell and tissue structure, as well as on their functional modifications under physiologic and pathologic conditions. All these findings have a direct translation into how these same cells look under the light microscope. In the present article, the main light microscopic features of the cell cytoplasm, the nucleus, and the extracellular matrix are reviewed, in the context of the underlying ultrastructural changes. Acquaintance with this ultrastructural background may prove extremely helpful to withdraw more abundant and more precise information from conventional light microscopy.
Key words: Electron microscopy, clear cells, rhabdoid cells, granular cells, foamy cells.
INTRODUCCIÓN
Una cualidad inherente a la microscopía electrónica de transmisión es que permite una mejor comprensión de la causa del aspecto óptico de las células y los tejidos normales, así como de sus cambios fisiológicos o patológicos. Así, a través de la microscopía electrónica, es posible adquirir un conocimiento más profundo de las razones que subyacen en las diferencias de color, textura y aspecto de las células y tejidos que caracterizan las distintas enfermedades. El propósito de esta revisión es correlacionar los principales fenotipos celulares con su substrato ultraestructural, tanto por lo que se refiere a sus características citoplasmáticas como nucleares, así como a algunos aspectos del estroma adyacente (1-5).
CITOPLASMA
1. Citoplasma eosinófilo
La eosinofilia traduce la existencia de un pH predominantemente básico. Por tanto, aquellas estructuras que tengan un elevado contenido proteico serán con frecuencia eosinofílicas, debido al predominio de su radical NH3. Un aspecto eosinófilo puede estar asociado con distintas texturas (granular, esmerilada, fibrilar, etc.), en función de cual sea la organela o estructura predominante en dicha célula.
La textura granular está relacionada, en general, con la presencia de estructuras abundantes, relativamente pequeñas y uniformes (fig. 1). Las organelas que con mayor frecuencia se asocian con este aspecto son las mitocondrias (oncocitomas), los lisosomas (tumores de células granulares) y los gránulos de secreción. En función de los radicales que predominen, los gránulos de secreción pueden ser también basofílicos, pero la mayoría de ellos son de aspecto eosinófilo. El ejemplo paradigmático lo constituyen los gránulos de zimógeno del páncreas, que presentan un contorno redondo y una textura electrondensa muy compacta. Los gránulos de mucina tienden a ser pálidos o casi transparentes si están hidratados, lo que, en el microscopio electrónico, se traduce por un aspecto finamente reticulado y una escasa densidad electrónica. No obstante, cuando la hidratación de la mucina es escasa o nula, las células en anillo de sello poseen un citoplasma granular intensamente eosinófilo, que se corresponde con un aspecto electrondenso al microscopio electrónico. Los gránulos exocrinos son habitualmente más fáciles de identificar al microscopio óptico y confieren una granularidad más grosera, mientras que los gránulos endocrinos dan lugar a una apariencia granular mucho más fina y sutil, prácticamente imperceptible. Por último, puede también observarse una apariencia granular más tosca en aquellos citoplasmas que contienen abundantes organelas de distintos tipos (retículo, mitocondrias, lisosomas, etc.) dispuestas de manera desordenada (2).
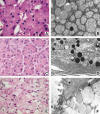
Fig. 1: Citoplasmas
eosinófilos granulares: a) Imagen óptica finamente granular típica de un
oncocitoma. b) Imagen ultraestructural del mismo tumor, con el citoplasma
masivamente ocupado por mitocondrias. c) Células acinares del páncreas con
aspecto eosinófilo granular en la mitad apical del citoplasma y color basófilo
en la mitad basal. d) Las áreas eosinófilas corresponden a los gránulos de
zimógeno y las basófilas al retículo rugoso. e) Aspecto granular eosinófilo
pálido en un carcinoma con células en anillo de sello. f) La relativa palidez
del citoplasma de estas células se debe al grado variable de hidratación que
presentan los gránulos de mucígeno, que equivale a las diferencias en densidad
electrónica que presentan al microscopio electrónico.
El aspecto en «vidrio esmerilado» puede observarse tanto en células neoplásicas como no neoplásicas. Entre las últimas se incluyen algunas alteraciones hepáticas inducidas por fármacos o por virus, que dan lugar a los hepatocitos esmerilados. Este aspecto suele estar asociado con abundante retículo endoplasmático liso. Ésta es también una organela muy abundante en células endocrinas secretoras de esteroides. Estas células pueden mostrar un aspecto variable al microscopio, que traduce su estadio funcional: cuando predomina el aspecto esmerilado debido a un acúmulo masivo de retículo liso, se trata de células en fase de síntesis; por el contrario, cuando predominan las vacuolas de grasa, suele tratarse de células menos activas (3). Otro tipo de estructura cuyo acúmulo homogéneo puede dar lugar a un aspecto esmerilado son los filamentos intermedios. Es lo que ocurre por ejemplo en los queratoacantomas o en algunos hepatocarcinomas. Finalmente, la presencia de vesículas muy finas puede también resultar en una morfología esmerilada al microscopio óptico, tal como ocurre en algunos tumores endocrinos con retículo liso microvesiculado o en algunos carcinomas de células renales de tipo cromófobo (6).
Los citoplasmas de aspecto fibrilar suelen deberse también a la presencia de filamentos intermedios (fig. 2). Así, los tonofilamentos son haces de citoqueratina, particularmente frecuentes en carcinomas de células escamosas, pero también presentes en muchos otros tumores epiteliales, mesoteliomas y sarcomas sinoviales. En el carcinoma escamoso, existen habitualmente células con una gran profusión de dichos tonofilamentos, que a menudo forman agregados perinucleares concéntricos. Esta disposición da lugar a la apariencia característica de las células disqueratósicas y puede también detectarse mediante luz polarizada (fig. 2A). En células no escamosas, es poco frecuente que el acúmulo de tonofilamentos dé lugar a una imagen detectable al microscopio óptico (7).
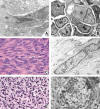
Fig. 2: Citoplasmas
eosinófilos fibrilares: a) Célula escamosa con un masivo acúmulo de
tonofilamentos que da lugar a las imágenes características de disqueratosis. b)
Células de un tumor rabdoide, con ovillos paranucleares de filamentos
intermedios (*) entremezclados con algunas organelas. c) Proliferación de
células fusiformes con citoplasma fibrilar eosinófilo y núcleo de contorno
irregular. d) Estas células poseen abundantes filamentos de actina y su
contracción es responsable de las invaginaciones del núcleo, características de
las proliferaciones de músculo liso o de miofibroblastos. e) Imagen histológica
de un tumor de partes blandas con núcleos de cromatina densa y contorno
irregular. f) La presencia de sarcómeras dispuestas de manera asimétrica es
característica del rabdomiosarcoma y su contracción desordenada da lugar a
irregularidades extremas del contorno nuclear, que suelen ser más acusadas en
uno de los polos del núcleo.
Una proliferación de células fusiformes, en tejidos blandos, que presente un citoplasma de textura fibrilar tendrá a menudo un fenotipo muscular liso (figs. 2C y D) o miofibroblástico. La intensidad de la eosinofilia se correlaciona con la cantidad de filamentos de actina de estas células. Así, los miofibroblastos tienden a ser más pálidos que las verdaderas células musculares lisas y, además, en los miofibroblastos, existen áreas ocupadas por retículo endoplasmático rugoso (RER), por lo que presentan con frecuencia aspecto heterogéneo, con texturas distintas en diferentes partes del citoplasma. Por otro lado, en aquellas proliferaciones rabdomioblásticas con citoplasmas más abundantes, el aspecto suele ser intensamente eosinófilo, debido a la combinación de abundantes haces de actina y miosina. Puede ocurrir, no obstante, que un tumor de esta naturaleza contenga cantidades relativamente grandes de lípidos y glucógeno entremezclados con el componente filamentoso, con la consiguiente traducción óptica (8). Por último, en el sistema nervioso central, el aspecto fibrilar es muy característico de los astrocitos y sus proliferaciones, que contienen haces ondulados de proteína fibrilar ácida glial. En los gemistocitos, estas colecciones de filamentos son tan abundantes que dan lugar a un aspecto esmerilado o parecido a células rabdoides.
El llamado fenotipo rabdoide fue descrito por primera vez para definir las células características de un tumor renal que es una entidad clínicopatológica bien definida de la infancia. Posteriormente, se describieron en otros órganos tumores con un aspecto parecido y con diversos fenotipos (9,10). El aspecto rabdoide puede variar de fibrilar a esmerilado y se refiere a la presencia de un área redondeada bien definida en el citoplasma, que rechaza el núcleo hacia la periferia y que característicamente se asocia con la presencia de un nucleolo prominente. La correlación ultraestructural de este aspecto consiste en ovillos paranucleares de filamentos intermedios (habitualmente vimentina) entre los que se identifican numerosas organelas atrapadas (fig. 2B). Se ha sugerido que esta característica podría ser el reflejo de una alteración en la organización del citoesqueleto, que se produciría en células en vías de degeneración o con la vitalidad comprometida. Pueden observarse también ovillos de filamentos en tumores que no llegan a adoptar un aspecto rabdoide. En estos casos, se detecta una positividad paranuclear, puntiforme, con anticuerpos para citoqueratinas o vimentina. Éste es un dato muy útil en tumores neuroendocrinos, por ejemplo en el carcinoma de células de Merkel con el anticuerpo de para citoqueratina 20 o en el carcinoma de células pequeñas de pulmón con el anticuerpo para CAM 5.2, y también en algunos tumores de Ewing y en algunos melanomas.
La presencia de cristales o cristaloides puede ser responsable de la tinción eosinofílica de una determinada célula. Este hecho es particularmente frecuente en células plasmáticas, en las que las grandes cantidades de inmunoglobulinas que se acumulan en el retículo rugoso se disponen en una estructura homogénea o granular, correspondiente a los cuerpos de Russell del microscopio óptico. Otras estructuras típicas son los cristaloides de Reinke, que suelen ser poligonales e identifican las células de Leydig y los tumores que derivan de las mismas. Al microscopio electrónico, estos cristaloides muestran un característico aspecto enrejado. Otro ejemplo de cristales o cristaloides que confieren tonalidad eosinófila al citoplasma es el de los cristales que caracterizan al sarcoma alveolar de partes blandas, en el que estas estructuras, que son de forma romboidal o cuadrangular y presentan una textura en fino enrejado, coexisten con gránulos de prosecreción. En hematoxilina y eosina, son cristales levemente eosinofílicos y su presencia se pone de manifiesto de manera más clara por su intensa positividad con la técnica de PAS (4).
2. Citoplasma claro
Las células claras denominadas «vegetaloides» reciben este nombre por su aspecto vacío (figs. 3A y B). Las organelas de estas células se concentran tanto alrededor del núcleo como en la periferia, junto al plasmalema. Las verdaderas células claras se caracterizan por contener grandes acúmulos de glucógeno, que suelen extraerse al menos en parte durante el procesado de los tejidos (11). Los fijadores a base del alcohol tienden a conservar mejor el glucógeno, pero no son de uso universal ya que, por ejemplo, no permiten el estudio ultraestructural a partir de material parafinado en caso de que sea necesario. Existen carcinomas de células claras (de riñón, pulmón, útero y ovario entre otros), sarcomas de células claras (principalmente el melanoma de partes blandas) y melanomas de células claras, entre otras posibilidades. En la literatura, el término «de células claras» ha sido asociado a prácticamente todos los tipos de tumor, pero esta denominación tiene que utilizarse en el contexto adecuado para que tenga sentido. En ocasiones, tendrá implicaciones clínico-patológicas, pero en otros casos no es más que un detalle anecdótico o una presentación peculiar que hay que conocer para no diagnosticar erróneamente un tumor determinado.
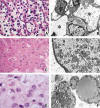
Fig. 3: Citoplasmas
claros: a) Células de citoplasma claro «vegetaloide» en un carcinoma de células
renales tipo células claras. b) Al microscopio electrónico, estas células
contienen cantidades variables de glucógeno y lípidos no rodeados de membrana,
que ocupan el citoplasma (*) y rechazan las organelas hacia la periferia o hacia
la zona paranuclear. c) Células de un carcinoma renal de tipo cromófobo que
muestran áreas intensamente eosinófilas y otras más claras y finamente
espumosas. d) Las áreas de aclaramiento celular o de aspecto espumoso en estos
tumores contienen las características vesículas isométricas. La eosinofilia se
debe a la coexistencia de cantidades variables de mitocondrias. e) Tumor de
partes blandas con células redondas vacuoladas y estroma mixoide. f) Se trata de
células que contienen abundantes vacuolas de lípido. Como el lípido se encuentra
libre en el citosol, cuando las gotas entran en contacto tienden a fusionarse en
gotas de mayor tamaño, rasgo característico de diferenciación adiposa.
El otro substrato principal de las células con citoplasma claro se debe a la presencia de cambios degenerativos y artefactos y, por lo tanto, es del todo inespecífico. Uno de los primeros cambios degenerativos de la célula es la dilatación del RER, debida a la entrada de agua por alteración de los mecanismos de control hidroelectrolítico. Aunque no siempre es un fenómeno degenerativo, el aspecto en forma de macrovesículas que se observa en el citoplasma de algunas células puede ser una clave diagnóstica para algunos tumores, como ocurre con las células fisalíferas del cordoma, pero este hallazgo debe situarse en el contexto adecuado (4). Por último, una conservación deficiente, una inclusión agresiva o una excesiva temperatura de la parafina pueden producir aclaramiento citoplasmático, a menudo asociado a otras alteraciones que permiten identificar el origen artefactual de este cambio.
El aspecto claro puede deberse también a vacuolización celular verdadera, no degenerativa. Ésta suele adoptar la forma denominada citoplasma espumoso. Con frecuencia, este aspecto se debe a la presencia de vacuolas lipídicas. La mayor parte de lípidos suele extraerse en el proceso de inclusión en parafina. En ocasiones, las vacuolas lipídicas no están delimitadas por una membrana celular, como es el caso del carcinoma de células renales de tipo células claras, en el que los lípidos pueden combinarse con glucógeno. Del mismo modo, en los liposarcomas de células redondas, las vacuolas lipídicas carecen de membrana a su alrededor. No obstante, estas vacuolas muestran una menor tendencia a fusionarse que en otras formas mejor diferenciadas de tumor adiposo. Así, los lipoblastos suelen contener vacuolas de diferentes tamaños debido a la coalescencia de los lípidos libres en el citosol (8) (figs. 3E y F). Por el contrario, en otros tumores las vacuolas lipídicas están delimitadas por una membrana y suelen ser el resultado de un proceso de fagocitosis. Estas vacuolas lipídicas son en realidad lisosomas secundarios y tienden a ser mucho más isométricas que las vacuolas de lípido no rodeadas por membrana. Suelen encontrarse en reacciones histiocitarias de naturaleza diversa o en proliferaciones histiocitarias neoplásicas, así como en algunos tumores epiteliales, tales como la variedad cromofílica o papilar del carcinoma de células renales. Aunque estas son situaciones en las que las vacuolas citoplasmáticas son características, es necesario señalar que en la mayoría de tumores malignos es posible encontrar tanto acúmulos lipídicos libres en el citosol, resultado de alteraciones en el metabolismo oxidativo de dichas células, como vacuolas con membrana, producto de fagocitosis por parte de las células tumorales, y por tanto ambas formas de presentación deben ponerse en el contexto adecuado para que resulten de utilidad diagnóstica. Algunos gránulos de secreción, tales como los de mucina, pueden también dar lugar a un aspecto vacuolizado, si bien no son vacuolas totalmente vacías como las que se observan en el caso de los lípidos. Por otra parte, como se ha señalado más arriba, las vesículas pueden ser demasiado pequeñas para que sean apreciables por microscopía óptica y entonces dan lugar a un aspecto en vidrio esmerilado. En otras ocasiones, en cambio, la presencia de vesículas se asocia a una textura óptica delicadamente espumosa. Una de las situaciones en las que esta característica constituye una clave diagnóstica es el carcinoma de células renales de tipo cromófobo. En algunos de estos tumores, dichas vacuolas coexisten con abundantes mitocondrias, con lo que las áreas espumosas se combinan con áreas granulares eosinófilas en el mismo citoplasma y en ocasiones se plantea el diagnóstico diferencial con un oncocitoma (6) (figs. 3C y D). Por otra parte, los cambios degenerativos pueden ser también responsables de una falsa vacuolización que suele relacionarse con vesiculación artefactual de RER y también, de manera muy frecuente, con la presencia de mitocondrias hinchadas y degeneradas (3).
Las luces intracelulares y los espacios intracelulares semejantes a luces constituyen hallazgos que, aunque no dan lugar a un aspecto claro del citoplasma, pueden tratarse en esta sección porque de algún modo producen áreas claras en el interior de las células (fig. 4). Las luces intracelulares son características de las proliferaciones glandulares o de vasos sanguíneos. Aunque la presencia de luces intracelulares suele denominarse «en anillo de sello», hay que subrayar que las verdaderas células en anillo de sello contienen en realidad abundantes gránulos de mucina que rechazan el núcleo. Del mismo modo, es necesario recordar que, si bien las luces intracelulares en células epiteliales suelen considerarse diagnósticas de adenocarcinoma pobremente diferenciado, pueden observarse también en células epiteliales normales, especialmente en células foliculares de tiroides, células epiteliales de mama y células uroteliales de la vejiga urinaria. Las luces intracelulares glandulares suelen tener microvellosidades en su superficie y, en especial en el caso de los tumores mamarios, acúmulos de secreciones densas en el centro de la luz («cuerpos magenta» de la citología de estas lesiones). La angiogénesis normal, con la apertura progresiva y convergencia de espacios luminales para formar canales, es reproducida por los tumores vasculares. También, en este caso, pueden observarse microvellosidades en la luz, pero están asociadas con filopodios y lamelipodios (proyecciones irregulares cilíndricas o laminadas, respectivamente), que permiten distinguir este tipo de luces de las de origen epitelial glandular (figs. 4C y D). Es importante no interpretar cualquier tipo de espacio vacío intracelular como una luz ya que muchos artefactos de procesamiento pueden resultar en agujeros, especialmente como consecuencia de la retracción desigual que se produce en el citoplasma de células con abundantes filamentos, como son las células del epitelio escamoso o las células musculares lisas (12) (figs. 4E y F).
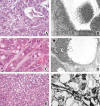
Fig. 4: Luces
verdaderas y falsas: a) Carcinoma de alto grado con espacios que semejan luces
glandulares pero podrían ser falsas luces porque contienen células necróticas.
b) Al microscopio electrónico, se hacen mucho más obvias las imágenes de
refuerzo apical de la imagen óptica, indicativas de la existencia de un ribete
en cepillo y, por tanto, de diferenciación glandular verdadera. c) Tumor
mediastínico con aspecto cordonal epitelioide y luces intra e intercelulares. d)
Estas luces contienen pseudópodos incurvados, filopodios y proyecciones
circulares, típicos de la diferenciación endotelial de un hemangioendotelioma
epitelioide. e) Imagen óptica de un tumor de la pared intestinal que presenta
múltiples vacuolas citoplasmáticas semejantes a luces. f) El examen del material
recuperado del bloque de parafina demuestra que se trata de artefactos de
retracción en las células de un tumor estromal.
3. Citoplasma basofílico
Existen situaciones en las que una textura granular puede asociarse a una mayor afinidad por la hematoxilina (figs. 5A, B, C y D). En la mayoría de estos casos, la basofilia granular se debe a que el citoplasma está cargado con abundantes cisternas de RER. Las cisternas de RER se encuentran presentes prácticamente en todas las células, pero sólo dan lugar a un citoplasma basofílico en aquellas en las que la síntesis proteica es elevada, como es el caso de las células plasmáticas, las neuronas, las células acinares del páncreas o las de la glándula salival. Estas células y los tumores relacionados con las mismas pueden tener un citoplasma característicamente granular azulado en las secciones teñidas con hematoxilina y eosina. Aunque la mayoría de los gránulos de secreción son eosinofílicos, los gránulos serosos de las glándulas salivales y, en ocasiones, también los del páncreas pueden ser intensamente basofílicos. Esta característica puede ser útil para identificar un tumor como carcinoma de células acinares, en cualquiera de estas dos localizaciones, aunque los gránulos no son tan abundantes en este tipo de tumor como en las células acinares normales de estos mismos órganos (13). Por último, algunos gránulos lisosomales, restos apoptóticos y grumos cromatínicos de células fagocitadas pueden impartir una apariencia granular azul intensa al citoplasma. Así se observa en algunas reacciones histiocitarias y, de manera esporádica, en algunos tumores, habitualmente tumores de alto grado con abundantes fenómenos de necrosis o apoptosis.
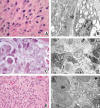
Fig. 5: a)
Células fusiformes con citoplasmas fibrilares de predominio basofílico pero con
áreas eosinófilas entremezcladas. b) Se trata de miofibroblastos en los que
predomina el retículo rugoso (basófilo), combinado con proporciones variables de
filamentos de actina (*) (eosinófilos). c) Fenómeno de «células claras y
oscuras» en un tumor neuroectodérmico. d) Imagen ultraestructural
correspondiente que demuestra la naturaleza degenerativa de este fenómeno. e)
Tumor con extensas áreas eosinófilas intercelulares de aspecto fibrilar. f)
Estas zonas corresponden a acúmulos de prolongaciones con microtúbulos,
vesículas y gránulos electrondensos, típicos de rosetas verdaderas en un
neuroblastoma.
Cuando se observan citoplasmas de tinción basofílica mal definida, de aspecto sucio o empastado, el substrato suele corresponder a diversas combinaciones heterogéneas de orgánulos, incluyendo RER y ribosomas. Con frecuencia, el aspecto sucio se debe a cambios degenerativos. Ésta es la base del denominado fenómeno de «células claras y células oscuras» en el que las células oscuras se encuentran en estado más avanzado de degeneración que las más claras (figs. 5C y D). Esta apariencia, que puede observarse tanto al microscopio óptico como al microscopio electrónico, fue la responsable, en los primeros años de la microscopía electrónica, de que en muchas descripciones de tumores de distinta naturaleza se consideraran erróneamente estos dos aspectos como dos subpoblaciones celulares con significado biológico.
CONTORNO CELULAR Y SUPERFICIE DE LA CÉLULA
En muchos tumores epiteliales y algunos no epiteliales, especialmente en algunos sarcomas, las células se encuentran agregadas entre sí de manera compacta. Este aspecto suele deberse a la presencia de abundantes uniones intercelulares, ya sea en forma de desmosomas, uniones adherentes o uniones estrechas. Tal apariencia es indicativa, por lo general, de una histogénesis epitelial verdadera (en sentido amplio que incluye las proliferaciones de células endoteliales y mesoteliales) (13,14). En otros casos, no obstante, puede ser simplemente el resultado de interdigitaciones celulares, directa aposición de las membranas de las células adyacentes o unión entre células mesenquimales por las denominadas densidades subplasmalémicas «en tándem». Esta última especialización es un hallazgo frecuente en los tumores musculares lisos o miofibroblásticos. Así pues, la estrecha aposición de células suele ser habitualmente resultado de uniones bien estructuradas, aunque existen múltiples excepciones a esta regla.
En muchos tumores, pueden observarse espacios intercelulares bien organizados, especialmente luces intercelulares y rosetas. De manera parecida a lo ocurre con las luces intracelulares, las luces intercelulares pueden observarse tanto en proliferaciones epiteliales glandulares como en tumores vasculares. Cuando un tumor forma estructuras glandulares bien definidas, ello es un signo de polarización celular, con la formación de complejos de unión en los dominios laterales y especializaciones de superficie en los dominios apicales: microvellosidades y, más raramente, cilios. Sin embargo, la formación artefactual de espacios centrales de necrosis en nidos sólidos de células tumorales puede dar lugar a una falsa impresión de diferenciación glandular. En ocasiones, coexisten ambos fenómenos, luces glandulares verdaderas con restos necróticos centrales. Para reconocer una luz glandular verdadera, puede ser útil identificar la presencia de un fino ribete eosinofílico en la superficie apical, debido a la presencia de microvellosidades, que no suele observarse en espacios pseudoglandulares (figs. 4A y B).
Los tumores adenomatoides suelen presentar un aspecto al microscopio óptico que los asemeja a tumores vasculares. Sin embargo, un examen cuidadoso de las superficies apicales de las luces y espacios que presentan estos tumores pone de manifiesto la existencia de un fino, irregular y mal definido ribete en cepillo que se debe a las características microvellosidades largas y tortuosas de estas células, en ocasiones acompañadas de secreción azulada muy tenue, que corresponde al ácido hialurónico que segregan. Este conjunto de rasgos pueden observarse también en mesoteliomas epiteliales convencionales. En ellos, las uniones de tipo desmosoma o unión estrecha suelen situarse en el dominio lateral de las células mesoteliales, pero próximas al dominio basal, lo que da lugar a que estas típicas microvellosidades se originen en la mayor parte del perímetro de dichas células (14). Ello produce con frecuencia a un efecto «en tachuela», con un ribete denso de microvellosidades en la mayor parte del contorno celular, rasgo que es más aparente con anticuerpos para determinadas proteínas vellositarias, como el HBME-1 (7). Aunque es muy característica, la presencia de largos procesos celulares no se encuentra en todos los mesoteliomas ni es exclusiva de los mismos. El término descriptivo «tumor de células en anémona» se acuñó al principio para referirse a carcinomas metastáticos a ganglio linfático que mostraban esta característica ultraestructural. Posteriormente, se aplicó a muchos otros tipos de tumor, tales como melanomas o distintas variedades de linfoma no-Hodgkin (linfoma con linfocitos vellosos y linfoma de células grandes de tipo villopódico) (7).
En las proliferaciones vasculares, pueden observarse grados y estadios variables de angiogénesis. Los espacios vasculares más incipientes no suelen estar conectados al flujo sanguíneo y, por tanto, las luces vasculares que se observan en este tipo de tumores suelen encontrarse vacías, lo que puede llevar al diagnóstico diferencial con tumores glandulares epiteliales o con el ya mencionado tumor adenomatoide. El citoplasma más pálido y los núcleos más vesiculares, a menudo indentados, de las células endoteliales, pueden ser de utilidad para llegar al diagnóstico correcto. Asimismo, además de estructuras de aspecto microvellositario, el examen ultraestructural pone de manifiesto la existencia de pseudópodos y lamelipodios que son característicos de células endoteliales y excluyen la posibilidad de un tumor glandular (4) (figs. 4C y D).
Otras estructuras intercelulares son las que se observan fundamentalmente en tumores neuronales o neuroectodérmicos, en forma de rosetas verdaderas y pseudorosetas. Las primeras están constituidas por conglomerados de prolongaciones celulares que crean un característico patrón fibrilar (figs. 5E y F). En microscopía óptica, estos procesos celulares pueden ser difíciles de distinguir de estructuras similares pero constituidas por acúmulos radiales de colágena, que se observan en algunos tumores miofibroblásticos o schwannianos. En estos casos, el aspecto ultraestructural de las células adyacentes es habitualmente muy distinto, ya que en los tumores con diferenciación neuronal se observan microtúbulos dispuestos longitudinalmente, vesículas sinápticas y ocasionales gránulos electrondensos; en los tumores miofibroblásticos se observa el característico aspecto bifenotípico, con abundante retículo endoplasmático rugoso y acúmulos de actina (figs. 5A y B) y, en los tumores de nervio periférico, las prolongaciones celulares rodeadas completamente por lámina externa y también, de manera ocasional, formando mesoaxones. Existen, por otro lado, las llamadas pseudo-rosetas que pueden corresponder bien a espacios pseudoglandulares creados por células neuronales o neuroepiteliales y, en especial, ependimarias, o bien a estructuras papilares en las que las células se disponen de manera radial alrededor de un vaso sanguíneo central. El primer tipo de pseudo-roseta puede ser particularmente difícil de distinguir, con el microscopio óptico, de las pequeñas glándulas o estructuras acinares de un carcinoma poco diferenciado. En el examen ultraestructural, las pseudo-rosetas ependimarias son fáciles de reconocer por sus microvellosidades y cilios abundantes («blefaroplastos») (15).
MORFOLOGÍA NUCLEAR
El aspecto del núcleo es una de las principales fuentes de información tanto en Citopatología como en Histopatología (16). Del mismo modo, en microscopía electrónica, las sutiles variaciones en la textura, la forma y el contorno del núcleo suelen ser de gran valor. Así, el grado de condensación y granularidad de la cromatina suele relacionarse con la ploidía y con el predominio de heterocromatina. Los núcleos pálidos o de aspecto homogéneo grisáceo suelen contener un predominio de eucromatina, mientras que la cromatina grosera o la llamada cromatina en «sal y pimienta» suelen deberse a grados variables de compactación de la heterocromatina. En cuanto a las características del nucleolo, la cantidad de cromatina asociada al mismo determinará si éste presenta su característica tonalidad eosinófila (cuando hay poca cromatina asociada) o basófila (cuando la cromatina asociada es más abundante). Aunque suele ser difícil apreciarla al microscopio óptico, la existencia de múltiples nucleolos suele relacionarse con alteraciones en los mecanismos moleculares de ensamblaje del nucleolo, problemas que son más frecuentes en células tumorales. Tanto la presencia de nucleolos múltiples como otras características nucleolares, tales como el aspecto «serpenteante» característico del seminoma (nucleolo irregular, de estructura abierta, de aspecto disperso y con escasa cromatina asociada), pueden observarse con facilidad mediante microscopía electrónica. La correlación de estos rasgos ultraestructurales con la morfología óptica es más fácil en preparaciones citológicas, pero puede valorarse también en cortes de parafina. Por último, los nucleolos de gran tamaño, en especial cuando están adosados a la membrana nuclear, suelen asociarse con una intensa actividad de síntesis proteica, frecuente tanto en tumores malignos como en tejidos en regeneración (3). Así mismo, se ha demostrado que, en las células tumorales, el tamaño nucleolar se correlaciona con la actividad proliferativa (17).
En ocasiones, resulta difícil distinguir ópticamente el nucleolo de determinadas inclusiones nucleares, especialmente algunas inclusiones víricas, pero un examen cuidadoso puede poner de manifiesto el componente azulado de cromatina asociado al nucléolo, que distingue a esta estructura de las inclusiones víricas más frecuentes. En algunos tumores, la presencia de inclusiones nucleares visibles al microscopio óptico es una característica diagnóstica muy útil. Las inclusiones nucleares verdaderas deben distinguirse de las denominadas pseudoinclusiones nucleares (2-4). Estas últimas son en realidad invaginaciones o protrusiones del citoplasma que producen una deformidad en el contorno nuclear. Éste es el tipo de inclusión que se observa característicamente en el melanoma, en sarcomas pleomórficos y en el carcinoma papilar de tiroides, entre otros tumores. Por otro lado, las inclusiones nucleares verdaderas pueden deberse a múltiples substratos ultraestructurales, los más característicos de los cuales son los agregados filamentosos de los adenocarcinomas endometriales y los agregados microtubulares del carcinoma bronquioloalveolar (2-4) (fig. 6A). Estas estructuras se encuentran realmente dentro del núcleo y, por tanto, cuando se examinan al microscopio electrónico se hace evidente que no están delimitadas por la cubierta nuclear ni por cromatina, a diferencia de lo que ocurre en las pseudoinclusiones (7).
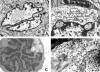
Fig. 6: a)
Núcleo de un carcinoma bronquioloalveolar, con las características inclusiones
nucleares verdaderas microtubulares, responsables de grados variables de
aclaramiento nuclear al microscopio óptico. b) Típicos «bolsillos» nucleares
propios de células linfoides, pero que no indican necesariamente su carácter
maligno. c) Linfocito T con delicadas irregularidades del contorno nuclear. d)
Imagen ultraestructural de un estroma mixoide: la proporción de colágena es muy
baja y predominan los mucopolisacáridos, que adoptan un característico aspecto
reticulado.
El contorno nuclear es una característica citológica importante en muchos tumores. Así, un núcleo con aspecto rugoso simétrico, con pliegues difusos en todo su perímetro, suele ser característico de los linfocitos T (fig. 6C), pero también muchos linfocitos B tienen irregularidades nucleares, especialmente los centrocitos y los linfocitos del manto. En el caso de los linfocitos B, los plegamientos de la cubierta nuclear no suelen ser tan complejos ni difusos. Una clave ultraestructural clásica en el diagnóstico de linfoma es la presencia de delicadas invaginaciones periféricas entre el citoplasma y la cubierta nuclear, que dan lugar a las denominadas proyecciones y bolsillos nucleares («nuclear pockets») (fig. 6B). Muchos subtipos de células reticulares se caracterizan por plegamientos e invaginaciones nucleares pero en estas células la eucromatina predomina sobre la heterocromatina (2-4).
Las irregularidades de la cubierta nuclear siguen algunos patrones característicos que ayudan a comprender el aspecto óptico del núcleo y que pueden ayudar a identificar la célula de origen. Así, un contorno nuclear simétricamente plegado es típico de las células musculares lisas y de los miofibroblastos, ya que se debe a la contracción espontánea e irregular de estas células, en las que los filamentos de actina se encuentran distribuidos de manera homogénea. Por otro lado, los núcleos del rabdomiosarcoma suelen estar desplazados a la periferia de la célula y presentan plegamientos asimétricos, con hendiduras más prominentes en el polo en que el citoplasma es más abundante y más rico en actina y miosina, que se contraen de manera desorganizada. Por último, los melanomas y los sarcomas pleomórficos pueden presentar irregularidades tan extremas del contorno nuclear que resultan visibles al microscopio óptico (8).
MATRIZ INTERCELULAR
Al igual que ocurre en el tejido normal, el aspecto óptico de la matriz intercelular de los tumores depende del equilibrio entre la cantidad de componentes fibrilares y amorfos y del grado de hidratación de estos últimos. Así, puede tener un aspecto denso o hialinizado si predominan los haces de colágena densamente empaquetados, con una textura fibrilar u ondulada, pero también cuando se acumula abundante material de membrana basal (colágeno tipo IV), lo que habitualmente da lugar a un aspecto más amorfo y eosinófilo. Por otro lado, un estroma laxo o mixoide se relaciona con el predominio de una matriz extracelular amorfa, rica en proteoglucanos y ácido hialurónico (fig. 6D). Dependiendo de la cantidad de agua que retienen estas moléculas altamente hidrofílicas, así como de la cantidad de colágeno asociado, el aspecto será más o menos mucoide y la tinción será más o menos basofílica o eosinofílica (3).
Hasta aquí, hemos revisado algunos aspectos de la morfología de las células y tejidos tanto normales como patológicos, en los que existe una buena correlación entre la microscopía óptica y su contrapartida electrónica. Es posible entender mejor y obtener una información más precisa y provechosa de los datos que proporciona la microscopía óptica, si se conoce el substrato ultraestructural de las diferentes enfermedades. El microscopio electrónico constituye una herramienta ideal para la comprensión de las bases patogenéticas y de la morfogénesis de los distintos procesos patológicos. Por todo ello, es muy recomendable que los patólogos, especialmente durante el período de formación, puedan familiarizarse con las imágenes que proporciona este instrumento.
AGRADECIMIENTOS
A los técnicos Luís Magán y María Andrea García por su excelente labor en el laboratorio de microscopía electrónica.
Al Dr. Sergio Serrano, Jefe del Servicio de Anatomía Patológica del Hospital del Mar, por su decisiva apuesta por la microscopía electrónica a lo largo de los años.
BIBLIOGRAFÍA
Dardick I, Robb I. Primer of Diagnostic Electron Microscopy for Pathologists-in-Training. Society for Ultrastructural Pathology and Pathology Images Inc, editores. 2nd Edition, 2006.
Ghadially FN. Diagnostic Electron Microscopy of Tumors. London: Butterworths; 1985.
Ghadially FN. Ultrastructural Pathology of the Cell and Matrix. Boston: Butterworth-Heinemann; 1997.
Erlandson RA. Diagnostic Transmission Electron Microscopy of Tumors. New York: Raven Press; 1994.
Ordóñez NG, Mackay B. Electron microscopy in tumor diagnosis: indications for its use in the immunohistochemical era. Hum Pathol 1998; 29: 1403-11.
Montes Moreno S, Alemany Benítez I, Martínez González MA. Ultrastructural studies in a series of 18 cases of chromophobe renal cell carcinoma. Ultrastruct Pathol 2005; 29: 377-87.
Hammar SP. Metastatic adenocarcinoma of unknown primary origin. Hum Pathol 1998; 29: 1393-402.
Erlandson RA, Woodruff JM. Role of electron microscopy in the evaluation of soft tissue neoplasms, with emphasis on spindle cell and pleomorphic tumors. Hum Pathol 1998; 29: 1372-81.
Weeks DA, Beckwith JB, Mierau GW, Zuppan CW. Renal neoplasms mimicking rhabdoid tumor of kidney. A report from the National Wilms’ Tumor Study Pathology Center. Am J Surg Pathol 1991; 15: 1042-54.
Weeks DA, Malott RL, Zuppan CW, Liwnicz BH, Beckwith B. Primitive cerebral tumor with rhabdoid features: a case of phenotypic rhabdoid tumor of the central nervous system. Ultrastruct Pathol 1994; 18: 23-8.
Alameda F, Lloreta J, Ferrer MD, Corominas JM, Galitó E, Serrano S. Clear cell meningioma of the lumbosacral spine with chordoid features. Ultrastruct Pathol 1999; 23: 51-8.
Ferrer MD, Lloreta J, Corominas JM, Ribalta T, Iglesias M, Serrano S. Signet ring epithelioid stromal tumor of the small intestine. Ultrastruct Pathol 1999; 23: 45-50.
Lloreta J, Serrano S. The current role of electron microscopy in the diagnosis of epithelial and epithelioid tumors. Semin Diagn Pathol 2003; 20: 46-59.
Oury TD, Hammar SP, Roggli VL. Ultrastructural features of diffuse malignant mesotheliomas. Hum Pathol 1998; 29: 1382-92.
Mierau GW, Weeks DA, Hicks J. Role of electron microscopy and other special techniques in the diagnosis of childhood round cell tumors. Hum Pathol 1998; 29: 1347-55.
Turbat-Herrera E, Herrera G. Electron microscopy renders the diagnostic capabilities of cytopathology more precise: an approach to everyday practice. Ultrastruct Pathol 2005; 29: 475-82.
Lloreta J, Ferrer MD, Corominas JM, Serrano S, Pavesi M, Mackay B. Prediction of recurrence and nucleolar features in node-negative breast carcinoma: An ultrastructural study. Virchows Archiv. 2002; 440: 280-4.