
Vol. 40, n.º 3, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 3, 2007 |
|
Homenaje
al Dr. Francisco José Martínez Tello |
ORIGINALES
Yolanda Rodríguez Gil1, Miguel A. Martínez González1, Santiago Montes Moreno1, M.ª Paz Ortega Serrano2, Gabriel Usera Sárraga1
1 Departamento de
Anatomía Patológica. Hospital Universitario 12 de Octubre.
2 Departamento de Anatomía Patológica. Hospital Universitario de la
Princesa.
yolandarodriguez@hotmail.com
RESUMEN
Introducción: Aunque la clasificación actual de las neoplasias epiteliales renales del adulto basada en rasgos morfológicos y citogenéticos es completa y reproducible, existen todavía entidades de difícil diagnóstico diferencial cuando se utiliza únicamente el microscopio óptico. El objetivo de este trabajo es revisar las características ultraestructurales de los diferentes subtipos de tumores epiteliales renales del adulto. Hacemos un énfasis especial en aquellas entidades que pueden presentar un difícil diagnóstico diferencial histológico. La serie incluye además la descripción ultraestructural de tumores infrecuentes escasamente descritos en estudios previos. Material y métodos: De los archivos de la sección de microscopía electrónica del departamento de Anatomía Patológica del Hospital Universitario 12 de Octubre de Madrid, se recogieron todos los casos de tumores epiteliales renales del adulto con material disponible para estudio ultraestructural, reuniéndose una serie de 72 casos. El diagnóstico se basó en los criterios histológicos, histoquímicos e inmunohistoquímicos admitidos actualmente en base a la última clasificación de la OMS publicada en 2004. Resultados y discusión: La casuística de esta serie incluía 24 carcinomas renales de células cromófobas (CRC), 18 oncocitomas renales, 14 carcinomas renales de células claras o convencionales (CRCC), 4 carcinomas renales de tipo papilar (PRC), 2 carcinomas sarcomatoides, 2 carcinomas de ductos colectores de Bellini, un tumor de células del aparato yuxtaglomerular, un carcinoma neuroendocrino, un tumor carcinoide, 2 nefromas quísticos, 2 carcinomas uroteliales papilares y un tumor híbrido. Existían rasgos distintivos entre las diferentes entidades. CRC mostraba abundantes vesículas citoplasmáticas en relación con imágenes de degeneración hidrópica de las crestas mitocondriales que eran la mayoría de morfología tubulovesicular, excepto en la variante eosinofílica . En esta última variante del CRC las mitocondrias conservaban la morfología de crestas laminares similares a las del oncocitoma, se cree que esta variante podría estar asociada a un mejor pronóstico. El oncocitoma mostraba citoplasmas ocupados por abundantes mitocondrias con largas crestas laminares. El CRCC tenía característicamente abundante cantidad de lípidos y glucógeno citoplasmáticos. El PRC se caracterizaba por la disposición de las células rodeando ejes fibrovasculares y sustentadas por una gruesa membrana basal. Las células mostraban microvellosidades apicolaterales. El carcinoma sarcomatoide mostraba células fusiformes con algunos rasgos de diferenciación epitelial. El carcinoma de ductos colectores de Bellini formaba estructuras tubulares similares a los ductos colectores con microvellosidades poco desarrolladas como ocurre en el túbulo distal de la nefrona. El carcinoma neuroendocrino y el carcionide estaban formados por células pequeñas poligonales. El tumor carcinoide contenía característicamente gránulos electrondensos rodeados de membrana identificados como gránulos típicos neurosecretores. El tumor de células yuxtaglomerulares contenía gránulos romboidales con matriz cristalina. El nefroma quístico mostraba arquitecturalmente una única capa de células poligonales apoyadas en una membrana basal bien definida, tapizando formaciones quísticas de distinto tamaño. El carcinoma urotelial papilar no tenía rasgos ultraestructurales específicos pero combinados con las características clínicopatológicas permitían confirmar la sospecha diagnóstica. Conclusión: Hemos revisado las características ultraestructurales distintivas de cada uno de los tumores epiteliales renales del adulto que pueden ayudar al diagnóstico diferencial. Los hallazgos ultraestructurales son en el momento actual una importante ayuda diagnóstica que contribuye a la correcta clasificación de los tumores renales y permite avanzar en el conocimiento de la histogénesis de estas neoplasias.
Palabras clave: carcinoma renal, microscopio electrónico, ultraestructura.
SUMMARY
Introduction: Although the current classification of renal epithelial neoplasms is comprehensive and reproductible it is still difficult to classify some renal epithelial neoplasms by light microscopic examination alone. Electron microscopy can contribute to highlight some cytological details of diagnostic value. The objectives of this study were to determine the specific features that contribute to distinguish histologic subtypes of renal epithelial tumors on the basis of ultrastrucutral morphology. Special emphasis is made on those overlapping histological features such as eosinophilic variants of chromophobe renal cell carcinoma and oncocytoma. We also include a description of more unusual tumors with ultrastructural characteristics reported infrequently. Material and methods: The files of the diagnostic electron microscopy section of the Department of Pathology of Hospital Universitario 12 de Octubre of Madrid provided 72 primary epithelial renal tumors with tissue for electron microscopy study. The selected cases were reviewed and classified according the last accepted classification published by WHO in 2004. Results and discussion: Cases were histologically classified into 24 chromophobe renal cell carcinoma (CRC), 18 renal oncocytoma, 14 conventional (clear cell) renal cell carcinoma (CRCC), 5 papillary renal cell carcinoma (PRC), 2 sarcomatoid variants of renal cell carcinoma, 2 collecting duct carcinoma, one juxtaglomerular cell tumor, one neuroendocrine carcinoma, one carcinoid tumor, 2 ystic nephroma, 2 papillary transitional cell carcinoma and one hybrid tumor. The ultrastructural findings were distinctive for the different subtypes. CRC showed characteristically abundant cytoplasmic vesicles apparently related to hydropic degeneration of mitochondria cristae which showed, generally tubulovesicular morphology except in the eosinophilic variant of CRC, whose mitochondria conserved lamellar cristae similar to that found in oncocytoma, this could be related with a better prognosis. Renal oncocytoma showed cytoplasm packed with many mitochondria with long, lamellar cristae. CRCC had characteristically abundant amounts of cytoplasmic lipid and glycogen. PRC was characterized by cells surrounding fibrovascular cores with basal lamina of variable thickness. Most of them showed apicolateral microvilli. Sarcomatoid renal cell carcinoma showed spindle shaped cells with occasional features of epithelial differentiation. Collecting duct type of renal cell carcinoma had ultrastructural appearance quite distinctive forming tubular structures that simulate collecting ducts. Microvillous borders were poorly developed similar to distal nephron and basal lamina was thick. Neuroendocrine and carcinoid tumors were formed by small polygonal cells. Carcinoid showed characteristically membrane bound darkly staining granules identified as typical neurosecretory granules. Juxtaglomerular cell tumor had renin-containing, rhomboid granules with an internal crystalline matrix. Cystic nephroma showed characteristic architecture with polygonal to cuboid cells in a cystic arrangement supported by a well defined basal lamina. Papillary transitional cell carcinoma lack specific ultrastructural features but when combined ultrastructural features with proper clinicopathologic settings diagnostic confirmation is available. Conclusion: Contributions of electron microscopy features to the differential diagnosis of renal cell carcinoma were reviewed and specific findings in the different subtypes are described. Some of these findings provide advanced knowledge into histogenesis of renal epithelial neoplasms.
Key words: Electron microscopy, ultrastructure, renal cell carcinoma.
INTRODUCCIÓN
En el momento actual la clasificación de la OMS de los tumores renales se basa en la delimitación clínico-morfológica de diversas entidades (1) que con frecuencia tienen una correlación citogenética específica (2). El estudio submicroscópico se considera de valor secundario. Sin embargo, la microscopía electrónica es una importante herramienta de diagnóstico en algunas entidades tales como el carcinoma cromófobo (3,4) y puede ser esencial en el diagnóstico diferencial de lesiones de aspecto sarcomatoide con hallazgos inmunohistoquímicos ambiguos (5). Por otra parte, los rasgos de microscopía electrónica pueden ser importantes en el diagnóstico de tumoraciones renales cuando el material es escaso, por ejemplo en el obtenido por punción aspiración (6,7). Es pues, conveniente estar familiarizado con el aspecto ultraestructural de estas lesiones (8). El presente trabajo describe nuestra experiencia en una serie de 72 tumores epiteliales renales del adulto estudiados mediante microscopía electrónica.
MATERIAL Y METODOS
Se han revisado todos los tumores renales del adulto incluídos en el archivo de la sección de microscopía electrónica del Departamento de Anatomía Patológica del Hospital 12 de Octubre de Madrid, en los últimos 25 años. En total se encontraron 85 casos de los cuales 9 se desestimaron por que el material no era adecuado para estudio. De los 76 tumores renales primarios del adulto restantes, 4 correspondían a tumores mesenquimales (dos angiomiolipomas, un fibrohistiocitoma maligno, un sarcoma indiferenciado). El estudio que presentamos se basa en el examen de 72 tumores renales primarios con diferenciación epitelial en adultos. Se recogieron los datos clínicos y macroscópicos de las historias clínicas y de los archivos del departamento de Anatomía Patológica.
El diagnóstico de todos los casos se basó en los criterios histológicos, histoquímicos e inmunohistoquímicos admitidos (1) y en las clasificaciones actuales (9).
Histológicamente se estudiaron entre 2 y 15 bloques de tumor y siempre al menos un bloque cada 2 cms de diámetro. Las secciones se tiñeron con HE, y cuando se consideró necesario se utilizaron técnicas de PAS y hierro coloidal.
Para estudio ultraestructural se incluyeron al menos 6 bloques de 1 mm3 que procedían de tejido fijado en formalina tamponada o de material en fresco que se fijó en reactivo de Karnovsky. Las muestras se postfijaron en tetróxido de osmio al 2% y se incluyeron en resina epox según protocolo estándar (10). Se realizaron cortes semifinos de 1 µm de espesor que se tiñeron con azul de toluidina para seleccionar áreas representativas de las lesiones histológicas. Los cortes ultrafinos se tiñeron según la técnica de Reynolds (11). De cada caso se estudiaron 2-3 muestras de zonas representativas.
La sistemática de estudio ultraestructural fue similar a la descrita por otros autores (12,13). En resumen se estudiaron los siguientes parámetros: 1) disposición de las células; 2) diferenciaciones de membrana: formación de luces, microvellosidades, uniones intercelulares, formación de membrana basal; 3) citoplasmas: tipos de organelas, con especial atención a mitocondrias y su morfología, lagos de glucógeno, vacuolas grasas, microvesículas y 4) núcleo: forma, disposición de la cromatina, nucleolos.
RESULTADOS
La edad de los pacientes variaba entre 28 y 84 años con una mediana de 63 años. En la distribución por sexos, 48 eran varones y 25 eran mujeres. El riñón afectado era el izquierdo en 30 de los casos y el derecho en 23. En 19 de los casos, procedentes de otros hospitales, no se pudo disponer de este dato de la historia clínica.
La casuística de esta serie se presenta en la tabla 1. El tamaño tumoral osciló entre 1,2 cm en el tumor más pequeño (carcinoma urotelial papilar) y 17 cm el de mayor tamaño (carcinoma renal de células cromófobas). El resumen de los hallazgos macroscópicos se recoge en la tabla 2.
Las características ultraestructurales se resumen en la tabla 3 y se exponen agrupadas por cada tipo de tumor a continuación:
Carcinoma renal de células cromófobas (n=24)
De los 24 tumores estudiados 7 casos mostraron en la tinción con HE, predominio de células eosinófilas y fueron diagnosticados de variante eosinófila de carcinoma renal de células cromófobas. Ultraestructuralmente todos los casos estaban formados por sábanas o nidos sólidos de células poligonales separadas del estroma por una lámina basal bien definida y polarizada. Se observaron diferenciaciones de membrana en forma de prolongaciones dendríticas y presencia de uniones intercelulares tipo complejos de unión frecuentemente, ocasionalmente se identificaron desmosomas. Sólo en uno de los casos se observaron microvellosidades cortas y gruesas. Todos los casos contenían microvesículas redondeadas de entre 100 y 350 nm de tamaño que se distribuían difusamente en el citoplasma, la mayoría con predominio perinuclear (fig. 1) excepto en los 7 casos de la variante eosinófila en que eran periféricas, algo menos abundantes y entremezcladas con las mitocondrias. La mayoría de microvesículas tenían una membrana única bicapa, menos frecuentemente se observaron vesículas con doble membrana interna y externa y otras con imágenes de «vesículas dentro de vesículas» (fig. 2). Algunos casos mostraron material electrondenso en el interior de las vesículas similar al observado focalmente en la matriz mitocondrial. Siete de los casos (1 de variante eosinófila y 6 de variante típica) mostraron dilataciones saculares de la membrana externa mitocondrial formando yemas que recordaban a las microvesículas citoplasmáticas. Las mitocondrias eran moderadamente abundantes en 13 de los casos, muy abundantes en 7 y escasas en 5. Las crestas eran mayoritariamente anómalas con aspecto tubulovesicular excepto en un caso de variante eosinófila que mostraban crestas lamelares (fig. 3). Otro de los casos mostró imágenes de mitocondrias multivesiculares. Se observaron en pequeña cantidad otras organelas como lisosomas, peroxisomas y escasa cantidad de glucógeno y lípidos. Los núcleos eran redondeados con frecuentes irregularidades en la mayoría de casos, la heterocromatina era escasa y periférica. Algunos casos presentaban nucleólos evidentes.

Fig. 1:
Carcinoma cromófobo. El tumor está constituido
por células poligonales con abundantes microvesículas claras que se distribuyen
entre las mitocondrias, en localización predominantemente perinuclear,
desplazando el resto de organelas a la periferia. ME, original 4.800x.
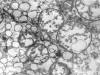
Fig. 2:
Carcinoma cromófobo. Detalle del citoplasma de
una célula neoplásica de carcinoma cromófobo. Se evidencian mitocondrias con
crestas tubulares y vesículas similares a las que aparecen libres en el
citoplasma. Obsérvense la imagen de «vesícula dentro de vesícula». ME, original:
64.000x.
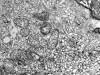
Fig. 3:
Carcinoma cromófobo variante oxifílica. Detalle
del citoplasma de una célula neoplásica que muestra típicas microvesículas y
mitocondrias con crestas laminares. ME, original 19.200x.
Oncocitoma (n=18)
Las células tumorales se disponían en todos los casos formando nidos delimitados por lámina basal polarizada. Sólo muy ocasionalmente (2 de los casos) se observaron luces intercelulares. Las membranas mostraban microvellosidades en uno de los casos, que también mostraba membrana basal engrosada con reduplicación. Las mitocondrias eran característicamente muy abundantes, en su mayoría con crestas lamelares (fig. 4). Únicamente 3 casos mostraron crestas tubulares (fig. 5) y 2 mostraron crestas apiladas. Los lípidos eran moderadamente abundantes y el glucógeno era escaso o ausente. La mayoría presentó lisosomas en la periferia de las células y aisladas microvesículas entre ellos. Los núcleos eran redondeados en todos los casos excepto 1 y con heterocromatina difusamente distribuída; en dos de los casos las células mostraban nucleólo patente.

Fig. 4:
Oncocitoma. El citoplasma de las células
neoplásicas está ocupado por mitocondrias de tamaño irregular y que con
frecuencia presentan crestas laminares apiladas. ME, original 6.400x.

Fig. 5:
Oncocitoma. Detalle del citoplasma de una célula
neoplásica que muestra crestas túbulovesiculares. ME. Original 96000x.
Carcinoma de células claras (CRCC) (n=14)
Con microscopía óptica ninguno de los 14 tumores estudiados fue clasificado en la variante de células granulares del CRCC. En todos los casos las células se disponen en grandes nidos o en sábana, separadas del estroma por la presencia de lámina basal multicapa polarizada. En dos casos la membrana basal mostraba discontinuidades. Se observaron microluces intercelulares o citoplasmáticas en todos los casos con presencia ocasional de complejos de unión. En aquellos casos en que el material estaba bien conservado (10/14) se observaron microvellosidades largas de tipo no enteroide polarizadas. Ninguno de estos tumores mostró cilios. Característicamente las células neoplásicas contenían lípidos abundantes, sólo en uno de los casos estaban presentes en cantidad moderada. Así mismo, los citoplasmas también eran ricos en glucógeno en la gran mayoría de los casos (fig. 6), siendo poco abundante en 5 de los tumores. La cantidad de lisosomas en las células tumorales era discreta. Las mitocondrias eran muy abundantes y mostraban degeneración hidrópica en 3 de los 14 casos, siendo escasas en el resto, con imágenes de pseudoinclusiones en un caso. Los núcleos eran en 12 de los casos redondeados, todos ellos con nucleólo evidente y mayoritariamente mostraban poca heterocromatina. Dos casos presentaban bordes nucleares irregulares con indentaciones. Uno de los casos mostró gránulos similares a los encontrados en las células de Paneth moderada o intensamente electrondensos, de núcleo irregular y rodeados de una unidad de membrana.
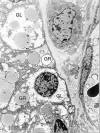
Fig. 6:
Carcinoma de células claras. Las células
neoplásicas de disponen nidos y sus citoplasmas están ocupados fundamentalmente
pos glucógeno (GL) y vacuolas grasas (GR). ME, original 4.800x.
Carcinoma papilar (n=4)
Los 4 casos mostraban patrón arquitectural papilar. Las células se disponen en hilera sobre la lámina basal que las separa del eje fibrovascular (fig. 7). La membrana basal mostraba grosor variable, en un caso era muy gruesa y reduplicada. Las células eran de morfología cuboidea en 3 de los casos y cilíndricas en uno de ellos, con presencia de microvellosidades de tipo no enteroide, largas y abundantes en 2 de los casos y algo más escasas en los otros 2. Todos los casos mostraron cantidades moderadas de lípidos y algunos lisososomas. Los núcleos eran muy irregulares con hendiduras profundas y con escasa heterocromatina.

Fig. 7:
Carcinoma de células renales variante papilar. El
tumor muestra finos ejes conjuntivos (E) revestidos por células de núcleo
irregular y con abundantes microvellosidades en las membranas apicales. ME,
original 4.800x.
Carcinoma sarcomatoide (n=2)
Ambos tumores mostraron células fusiformes dispuestas en sábana sobre un estroma rico en colágeno. En uno de los casos la matriz mostró focos de diferenciación condral. Se identificaron desmosomas y complejos de unión de forma ocasional en los dos casos. No se observaron prolongaciones de membrana, ni formación de membrana basal, ni vesículas pinocíticas. Ambos casos contenían abundante retículo endoplásmico rugoso, filamentos finos con cuerpos densos y en uno además, filamentos intermedios formando madejas densas de tipo haces de queratina. Las mitocondrias eran poco abundantes y con crestas laminares. los núcleos mostraban membrana irregular y gran tamaño respecto al citoplasma. No se encontraron signos de diferenciación específica.
Carcinoma de túbulos colectores (n=2)
En ambos tumores las células se disponen característicamente, formando ductos sobre lámina basal polarizada más gruesa que la que se observa en otros tumores renales (fig. 8). Las células formaban luces bien definidas, prácticamente sin microvellosidades. Las mitocondrias, lisososmas, peroxisomas y el resto de organelas eran poco abundantes y sin peculiaridades. Los núcleos eran redondeados irregulares y con abundante heterocromatina.

Fig. 8:
Carcinoma de conductos de Bellini. Se evidencia
una luz glandular revestida por células cubicas con alta proporción
núcleocitoplasmica con membrana apical lisa, sin microvellosidades. ME, original
4.800x.
Carcinoma neuroendocrino (n=1)
El único caso de carcinoma de células pequeñas de tipo neuroendocrino mostraba células poligonales, con una alta proporción núcleo-citoplasmática, se disponíans en nidos rodeados de membrana basal. Las células tenían diferenciaciones de membrana de tipo desmosomas, sin formación de microvellosidades. Las organelas citoplasmáticas eran muy abundantes especialmente las mitocondrias. No se observaron gránulos electrondensos, aunque el mal estado de conservación la muestra no permite descartar que estuvieran presentes en pequeño número.
Carcinoide (n=1)
EL tumor estaba constituído por células poligonales dispuestas en grandes nidos, separadas por una membrana basal discontínua. No se observaron microluces, ni microvellosidades en la superficie de las células. Las mitocondrias eran moderadamente abundantes sin peculiaridades. Como rasgo característico se identificaron abundantes filamentos intermedios con presencia de filamentos de vimentina en relación con gránulos de neurosecrección (fig. 9). Los núcleos eran redondeados con alta proporción núcleo-citoplásmica.
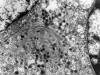
Fig. 9:
Tumor carcinoide. Detalle del citoplasma de una
célula neoplásica que muestra típicos gránulos electrodensos rodeados por
membrana y entremezclados con filamentos intermedios. ME, original 32.000x.
Tumor de células yuxtaglomerulares (n=1)
El único caso correspondiente a tumor yuxtaglomerular estaba formado por células redondeadas o poliédricas en nidos rodeados de membrana basal discontínua. Gran parte de las células mostraban abundantes vesículas de pinocitosis y una moderada cantidad de mitocondrias con crestas túbulovesiculares. El rasgo ultraestructural más característico era la presencia de cristales específicos de protogránulos de renina en forma de cuerpos romboidales, similares a los encontrados en las células del aparato yuxtaglomerular normal (fig. 10).

Fig. 10:
Tumor del aparato yuxtaglomerular. Detalle del
citoplasma de una célula neoplásica que muestra típicos gránulos romboidales de
prerrenina. ME, original 12.800x.
Nefroma quístico (n=2)
Ambos casos mostraron células cúbicas dispuestas alrededor de grandes luces sobre una membrana basal gruesa (fig. 11). Uno de ellos estaba mal conservado, dificultando el estudio de las organelas citoplasmáticas, el otro mostró abundantes lípidos, ocasionales acúmulos de glucógeno y mitocondrias con crestas lamelares en cantidad discreta. Las microvellosidades eran frecuentes en ambos casos, de tipo no enteroide y alargadas.
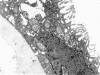
Fig. 11:
Nefroma quístico. Detalle de la pared de un
quiste que muestra células cúbicas con numerosas microvellosidades en la
vertiente apical y que se apoyan sobre una membrana basal muy gruesa. ME,
original 9.600x.
Carcinoma urotelial papilar (n=2)
Histológicamente ambos correspondían a un carcinoma urotelial papilar de alto grado. Las células eran grandes y se disponían en múltiples capas alrededor de ejes conectivo-vasculares. Se observaron prolongaciones dendríticas entre las membranas celulares y presencia de microvellosidades cortas y gruesas. Las mitocondrias eran moderadamente abundantes y de crestas laminares. Los núcleos eran grandes y muy irregulares. No se observaron signos específicos.
Tumor híbrido: cromófobo-carcinoma renal de células claras (n=1)
El caso corresponde a una paciente con dos tumoraciones renales ambas híbridas, aunque únicamente una de ellas se estudió ultraestructuralmente, la neoplasia estudiada correspondía a un carcinoma de morfología de células cromófobas que mostraba focos de carcinoma de células claras. Los rasgos ultraestructurales de cada una de estas dos áreas eran similares a los descritos en los respectivos tumores cuando aparecen de forma aislada, siendo la zona de carcinoma cromófobo muy abundante en microvesículas y con mitocondrias túbulovesiculares, y la zona de carcinoma de células claras con abundantes depósitos de glucógeno, algunos lípidos y mitocondrias tumefactas. El tumor contralateral que presentó esta paciente estaba constituído por un carcinoma de células cromófobas con focos de oncocitoma.
DISCUSIÓN
Los cambios recientes en la clasificación de los tumores renales inicialmente desarrollada por Thoenes et al (14), dejan algunos casos de difícil diagnóstico diferencial basándose sólo en rasgos morfológicos visibles en microscopía óptica (15). Nuestro estudio pretende recoger las características repetitivas de los tumores epiteliales renales más frecuentes, seleccionando el conjunto de rasgos más descriptivo que permita reconocer cada tipo de tumor. Existen similitudes citoarquitecturales entre el carcinoma de células renales de tipo cromófobo variante eosinófila, el oncocitoma renal, el carcinoma renal convencional variante de células granulares y el carcinoma papilar renal con células granulares. Sin embargo, están reconocidos como entidades clínicas independientes con importantes diferencias en el pronóstico y tratamiento (16). Recientemente se han realizado intentos de buscar marcadores inmunohistoquímicos que faciliten el diagnóstico diferencial entre oncocitoma y carcinoma renal de células cromófobas (17,18). Es en los casos controvertidos en los que el microscopio electrónico puede ser de gran utilidad. El presente estudio agrupa los rasgos distintivos de cada una de estas entidades acordes con las encontradas previamente por otros autores (19).
El carcinoma renal de células claras (CRCC) muestra en todos los casos gran abundancia de lípidos y de glucógeno. La superficie de las células tiene abundantes microvellosidades largas de tipo no enteroide, frecuentes microluces intercelulares y en algunos casos verdaderas luces con complejos de unión. Solamente en el carcinoma de túbulos colectores de Bellini y en el nefroma quístico se han identificado luces verdaderas, lo que permite delimitar bastante el diagnóstico en el caso de encontrar este hallazgo. Ninguno de nuestros casos mostró predominio de células granulares pero sí están descritas áreas focales con aspecto más eosinófilo o granular de los citoplasmas. Estas zonas pueden corresponder a un aumento de las mitocondrias en los citoplasmas (20), manteniendo el resto de características ultraestructurales de los CRCC. Otro hallazgo peculiar repetitivo encontrado en los 3 casos de CRCC , en que las mitocondrias eran abundantes, fue la presencia de degeneración hidrópica de las mismas, con crestas cortas y atenuadas, en consonancia con los hallazgos encontrados por Tickoo (3) en su serie de 7 casos de variante eosinofílica de CRCC. Los gránulos descritos en 1 de los casos de CRCC son similares a los encontrados en el 38% de los CRCC de la serie descrita por Krishnan y Truong (15) y previamente descritos por Blenc et al (21). Nosotros sólo los encontramos en uno de los casos, localizados en la periferia de las células, se distinguen por su densidad irregular que varía de media a intensa y se rodean de una membrana única. No puede descartarse como se ha postulado para otras inclusiones encontradas en estudios previos (15,22) que estos gránulos estén en relación al metabolismo de los lípidos (23), ya que sólo se han encontrado en los CRCC que se caracterizan por su abundancia en lípidos. Hasta el momento existen muy pocos estudios sobre este tipo de inclusiones (15). El hallazgo de núcleos redondos es constante y la presencia de nucleólo se ha relacionado con el grado nuclear (24).
El carcinoma papilar renal también puede tener ópticamente células granulares y plantear dificultades de diagnóstico, sin embargo el patrón de disposición de las células de tipo cuboideo o cilíndrico, sobre un eje conectivo, con microvellosidades es característico. La diferente cantidad de mitocondrias, que en todos nuestros casos eran de crestas laminares, determina el tipo de células más o menos eosinófilas.
No se observaron los glóbulos encontrados por otros autores en el carcinoma renal de células claras y en el papilar (25,26). Tal como se ha descrito en estudios previos (26), estos glóbulos se corresponden con inclusiones hialinas intracitoplasmáticas visibles con el microscopio óptico. Ultraestructuralmente muestran un centro fibrilar o granular rodeado de capas de membrana concéntricas, con o sin organelas alrededor que suelen mostrar matriz granular o electrondensa (27). Por tanto es un hallazgo que orienta el diagnóstico en el caso de estar presente, pero en el caso de estar ausentes, como es esta serie, no excluye los diagnósticos de CRCC o carcinoma papilar.
EL carcinoma de células cromófobas (CRC) ha sido exhaustivamente descrito en estudios previos (2,3,14,15,28). Los rasgos que orientan el diagnóstico son la presencia de microvellosidades más escasas, cortas y gruesas que en el carcinoma de células claras; las abundantes vesículas citoplasmáticas que sólo en un caso, de variante oxifílica, estaban en cantidad discreta y que frecuentemente se disponen alrededor del núcleo desplazando al resto de organelas a la periferia del citoplasma; y por último las mitocondrias que son característicamente anómalas. Encontramos predominio de crestas tubulares ó tubulovesiculares en todos menos en un caso, que se correspondía a la variante eosinofílica (fig. 3), siendo los otros 6 tumores de variante oxifílica, de crestas tubulovesiculares. Estos hallazgos coinciden con los encontrados en estudios previos sobre la ultraestructura de los CRC (29). Otros rasgos como la proyección de yemas desde la membrana externa mitocondrial y las densidades en la matriz, son también frecuentes, uno de los casos mostró mitocondrias multivesiculares con imágenes muy parecidas a las «vesículas dentro de vesículas» del citoplasma (fig. 2) , lo que reafirma la hipótesis del origen mitocondrial de las microvesículas (2,30). El caso de variante oxifílica con mitocondrias de crestas lamelares similares a las del oncocitoma y menor número de microvesículas (fig. 3), podría corresponder a la tercera variante de CRC que propuso Erlandson llamar variante oncocítica (14) y que requiere estudios pronósticos.
El oncocitoma renal a diferencia del CRC muestra escasas microvesículas desplazadas a la periferia por la abundancia de mitocondrias, en ningún caso las microvesículas se situaron en la zona perinuclear. Las mitocondrias eran mayoritariamente de crestas laminares, sólo excepcionalmente se vieron crestas apiladas (2 casos) o tubulares (3 casos) similares a las que se encuentran en el CRC, algunos autores han explicado este hallazgo como artefacto por cortes oblícuos o por ser de crestas tortuosas y las han llamado pseudotubulares. en cualquier caso se diferencian de las crestas dilatadas y túbulovesiculares descritas en el CRC. Los núcleos son redondeados con muy pocas irregularidades y las mitocondrias ocupan todo el citoplasma con escasez del resto de organelas.
Por otro lado existen tumores renales con escasos rasgos de diferenciación ó que muestran apariencia sarcomatoide en el microscopio óptico (31). En el estudio ultraestructural, nuestros dos casos mostraron células fusiformes con complejos de unión y desmosomas en un estroma colágeno. Las organelas citoplasmáticas eran habituales en cantidad y morfología. Únicamente era llamativa la abundancia de retículo endoplásmico rugoso dilatado y la presencia de filamentos finos con cuerpos densos y filamentos intermedios formando madejas densas de tipo haces de queratina (en un caso). Estos hallazgos corresponden a los rasgos ultraestructurales de un carcinoma sin signos de diferenciación. En estudios previos algunos de estos tumores mostraron características ultraestructurales más específicas, como diferenciación rabdomiosarcomatosa (32).
Cuando únicamente se encuentran aislados rasgos de diferenciación epitelial, nos hallamos ante la entidad de histogénesis controvertida, denominada carcinoma sarcomatoide (33), que muestra rasgos histológicos sarcomatoides y rasgos ultraestructurales característicos de tumores epiteliales, incluídos desmosomas y tonofilamentos (34). El estudio ultraestructural resultó complementario en el estudio de otros tipos de tumor que ya con el microscopio óptico mostraban rasgos característicos, como el carcinoma de túbulos colectores, carcinoma neuroendocrino, carcinoide, tumor del aparato yuxtaglomerular, nefroma quístico y carcinoma urotelial papilar. Son bien conocidos los rasgos ultraestructurales característicos de cada una de estas entidades (35,36,37,38,39,40,41) y se confirman en esta serie.
En el carcinoma neuroendocrino y en el carcinoide, el microscopio electrónico permite identificar habitualmente gránulos de secreción electrondensos que confirman el diagóstico. Estos gránulos son mucho más abundantes en el carcinoide y se asocian con filamentos de vimentina, como ocurre en nuestro caso (fig. 9). En el carcinoma neuroendocrino incluído en esta serie no se identificaron gránulos de secreción, debido probablemente al mal estado de conservación de la muestra, ya que el estudio inmunohistoquímico mostró positividad para cromogranina y sinaptofisina, ambos marcadores de diferenciación neuroendocrina, que se correlacionan con la presencia de gránulos de secreción en estudios previos (42,43,44). Los hallazgos de microscopía óptica son suficientes para identificar estos tumores, que por otra parte, son en general idénticos a los encontrados en otras localizaciones.
El tumor del aparato yuxtaglomerular muestra cuerpos romboidales típicos que permiten realizar el diagnóstico de certeza cuando morfológicamente los hallazgos son controvertidos, la ultraestructura se considera el método de diagnóstico de elección, pero el diagnóstico puede también apoyarse en los rasgos histológicos acompañados de positividad para inmunomarcadores de formas activas o inactivas de renina. Ocasionalmente se han descrito casos metastáticos en los que la ultraestructura resultó esencial para identificar la procedencia de las metástasis (45).
Los casos de nefroma quístico mostraron rasgos similares a los descritos previamente por otros autores 33 aunque no encontramos cilios como los descritos por Shimokama T et al (46).
Las características ultraestructurales repetitivas de estos tumores hacen el microscopio electrónico especialmente útil cuando únicamente se dispone de una muestra escasa, como ocurre en las preparaciones obtenidas mediante punción aspiración con aguja fina. Realizando un protocolo de inclusión rápida podría disponerse del diagnóstico ultraestructural, en una media de 6 horas, en casos en que la muestra es insuficiente para la valoración de rasgos con microscopía óptica.
Por todo ello concluimos que los hallazgos ultraestructurales son en el momento actual una importante ayuda diagnóstica que contribuye a la correcta clasificación de los tumores renales y permite avanzar en el conocimiento de la histogénesis de estas neoplasias. Es aconsejable reservar una muestra para estudio ultraestructural (tomada de material en fresco o de material correctamente fijado en formol tamponado) y decidir su procesamiento una vez conocidos los resultados histológicos.
BIBLIOGRAFÍA
Eble JN, Sauter G; Epstein JI, Sesterhenn IA, editors. Tumours of the urinary system and male genital organs. Lyon: IARC Press; 2004.
Argani P. The evolving story of renal translocation carcinomas.Am J Clin Pathol. 2006; 126: 332-4.
Montes Moreno S; Alemany Benítez I; Martínez González MA. Ultrastructural studies in a series of 18 cases of chromophobe renal cell carcinoma. Ultrastruct Pathol 2005; 29: 377-87.
Tickoo SK, Lee MW, Eble JN, Amis M, Christopherson T, Zarbo Rj, Amin MB. Ultrastructural observations on mitochondria and microvesicles in renal oncocytoma, chromophobe renal cell carcinoma and eosinophilic cell carcinoma. Am J Surg Pathol 2000; 24: 1247-56.
Herrera GA, Turbat-Herrera EA. The role of ultrastructural pathology in the diagnosis of epithelial and inusual renal tumors. Ultrastructural Pathol 1996; 20: 7-26.
Martínez González MA, Argüelles Pinto M,de Agustin de Agustín P, Vargas Castrillón J, Pérez-Barrios A. Value of ultrastructural studies in Fine Needle Aspiration biopsy diagnosis. Acta Cytol 1995; 39: 713-20.
Salamanca J, Alberti N, Pérez-Barrios A, López-Ríos F, Martínez-González MA, de Agustin P. Fine-needle aspiration of chromophobe renal cell carcinoma: Report of 4 cases and review of the literature. Acta Cytologica 2006; en prensa.
Picken MM. The evolving concept of renal neoplasia: impact of emerging molecular and electron microscopic studies. Ultrastructural Pathol 2005; 29: 277-82.
Murphy WM, Grignon DJ, Perlman EJ. Tumors of the kidney, bladder, and related urinary structures. Washington: American Registry of Pathology. Armed Forces Institute of Pathology; 2004.
Watson M. Staining of tissue sections for electron microscopy with heavy metals. J Biophysic and Biochem Cytol. 1958; 4: 475-80.
Reynolds E. The use of lead citrate at high PH as an electrón-opaque staining in electrón microscopy. J Cell Biol. 1963; 17: 208-10.
Erlandson RA. Diagnostic transmission electron microscopy of tumours. New York: Raven Press; 1994.
Herrera GA. The value of ultrastructural evaluation in the diagnosis of renal tumors: a general overview. Ultrastruct Pathol. 1996; 20: 1-6.
Thoenes W, Störkel St, Rumpelt HJ. Histopathology and classification of renal cell tumors (adenomas, oncocytomas and carcinomas). The basic cytological and histopathological elements and their use for diagnosis. Pathol Res Pract. 1986; 181: 125-43.
Reuter VE, Presti JC Jr. Contemporary approach to the classification of renal epithelial tumors. Semin Oncol. 2000; 27: 124-37.
Moch H, Passer T, Amin MB et al. Prognostic utility of recently recommended histologic classification and revised TNM staging system of renal cell carcinoma. Cancer 2000; 89: 604-14.
Garcia E, Li M. Caveolin-1 immunohistochemical analysis in differentiating chromophobe renal cell carcinoma from renal oncocytoma. Am J Clin Pathol. 2006; 125: 392-8.
Adley BP, Gupta A, Lin F, Luan C, Teh BT, Yang XJ. Expression of kidney-specific cadherin in chromophobe renal cell carcinoma and renal oncocytoma. Am J Clin Pathol. 2006; 126: 79-85.
Erlandson RA, Shek TWH, Reuter VE. Diagnostic significance of mitochondria in four types of renal epithelial neoplasms: An ultrastrustural study of 60 tumors. Ultrastruct Pathol. 1997; 21: 409-17.
Krishnan B; Truong LD. Renal epithelial neoplasms: The diagnostic implications of electron microscopic study in 55 cases. Human Pathol. 2002; 33: 68-79.
Blenc Am, Amin M, de Peralta- Venturina M et al. Paneth cell-like granules in convencional (clear cell) carcinoma. Immunohistochemical and ultrastructural characterization. Mod Pathol. 2000; 13: 94.
Carstens PH, Herrera GA, Turbat-Herrera EA, Listinsky CM, Levesque K.. Unique intracytoplasmic inclusion in a probable granular renal cell carcinoma. Ultrastructural Pathol. 1995; 19: 205-9.
Ghadially FN. Microbodies (Peroxisomes, microperoxisomes and catalosomes) in Ultrastructural Pathology of Cell and Matrix. London: Buterworths; 1988.
Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol. 1982; 6: 655-63.
Datta BN. Hyaline intracytoplasmic globules in renal carcinoma. Arch Pathol Lab Med. 1977; 101: 391.
Danbara N, Shikata N, Kawamura H, Shintaku M, Tsubura A. Eosinophilic cytoplasmic inclusions in papillary renal cell carcinoma.Med Mol Morphol. 2005; 38: 262-6.
Mackay B, Ordonez NG, Khoursand J, Bennington JL. The ultrastructure and immunocytochemistry of renal cell carcinoma. Ultrastruct Pathol. 1987; 11:483-502.
Abrahams NA, MacLennan GT, Khoury JD, Ormsby AH, Tamboli P, Doglioni C, Schumacher B, Tickoo SK. Chromophobe renal cell carcinoma: a comparative study of histological, immunohistochemical and ultrastructural features using high throughput tissue microarray. Histopathology. 2004 ; 45: 593-602.
Thoenes W, Störkel St, Rumpell HJ, Moll R, Baum HP, Werner S. Chromophobe cell renal carcinoma and its variants: a report on 32 cases. J Pathol 1988; 155: 227-37.
Akhtar M, Kardar H Linjawi T, Mc Clintock J, Ali MA. Chromophobe cell carcinoma of the kidney: a clinicopathologic study of 21 cases. Am J surg Pathol. 1995; 19: 1245-56.
Delahunt B. Sarcomatoid renal carcinoma: the final common dedifferentiation pathway of renal epithelial malignancies. Pathology. 1999; 31: 185-90.
de Peralta-Venturina M, Moch H, Amin M, Tamboli P, Hailemariam S, Mihatsch M, Javidan J, Stricker H, Ro JY, Amin MB. Sarcomatoid differentiation in renal cell carcinoma: a study of 101 cases. Am J Surg Pathol. 2001; 25: 275-84.
Deitchman B, Sidhu GS. Ultrastructural study of a sarcomatoid variant of renal cell carcinoma. Cancer. 1980; 46: 1152-7.
Picken MM, Fresco R. Mixed epithelial and stromal tumor of the kidney: preliminary immunohistochemical and electron microscopic studies of the epithelial component. Ultrastructural Pathol. 2005; 29: 283-6.
Kasper HU, Buhtz P, Kruger G, Samland D, Roessner A. Bellini duct carcinoma of the kidney -a case report. Gen Diagn Pathol. 1997; 143: 237-41.
Acconcia A, Miracco C, Mattei FM, deSanti MM, Del Vecchio MT, Luzi P. Primary carcinoid tumor of kidney. Light and electron microscopy, and immunohistochemical study. Urology. 1988; 31: 517-20.
Kodet R, Taylor M, Vachalova H, Pycha K. Juxtaglomerular cell tumor. An immunohistochemical, electron-microscopic, and in situ hybridization study. Am J Surg Pathol. 1994; 18: 837-42.
Eble JN, Bonsib SM. Extensively cystic renal neoplasms: cystic nephroma cystic partially differentiated nephroblastoma multilocular cystic renal cell carcinoma and cystic hamartoma of renal pelvis. Semin Diagn Pathol 1998; 15: 2-20.
Melis M, Petrozza V, Pulvirenti S, Eleuteri E, Mosca A, Angelini L, Carpino F. Transitional papillary cell carcinoma of the ureter: a histological and ultrastructural study. Histol Histopathol. 1994; 9: 287-94.
Masuda T, Oikawa H, Yashima A, Sugimura J, Okamoto T, Fujioka T. Renal small cell carcinoma (neuroendocrine carcinoma) without features of transitional cell carcinoma. Pathol Int. 1998; 48: 412-5.
Logothetou-Rella H, Karayiannis A, Vamvassakis E, Livaditou A, Pikramenos D, Nesland JM, Dimopoulos C. A cytologic, ultrastructural and immunocytochemical comparison of tumor cells and cell cultures originating in invasive bladder carcinoma. Eur Urol. 1992; 21: 146-50.
Dardick I, Rippstein P, Perkins G. Reliability of criteria for ultrastructural identification of neuroendocrine granules.Ultrastruct Pathol 1993; 17: 37-47.
Fossmark R, Martinsen TC, Qvigstad G, Bendheim MO, Kopstad G, Kashima K, Waldum HL. Ultrastructure and chromogranin A immunogold labelling of ECL cell carcinoids. APMIS. 2005; 113: 506-12.
Morgan KG, Banerjee SS, Eyden BP, Barnard RJ. Primary small cell neuroendocrine carcinoma of the kidney. Ultrastruct Pathol. 1996; 20: 141-4.
Shimokama T, Watanabe T. Multilocular renal cyst. Scanning and transmission electron microscopic observations.Pathol Res Pract. 1989; 184: 255-60.
Duan X, Bruneval, Hammadeh R et al. Metastatic yuxtaglomerular cell tumor in a 53 year old man. Am J Surg Pathol 2004; 28: 1098-102.