
Vol. 40, n.º 1, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 1, 2007 |
ORIGINALES
M.ª Elisa Prieto Sánchez, Myriam León Fradejas, M.ª Dolores Bautista Ojeda
Hospital Regional Universitario Carlos Haya.
Málaga.
elisaprieto@gmail.com
RESUMEN
Debido a la alta morbimortalidad del cáncer de pulmón y la poca efectividad de los tratamientos actuales, se buscan nuevas alternativas terapéuticas. Un objetivo básico de la investigación actual del cáncer es la identificación de las alteraciones genéticas implicadas en el desarrollo tumoral que pudieran constituir factores pronósticos en la evaluación de los pacientes, dianas terapéuticas de nuevos fármacos e incluso ser útiles para el diagnóstico precoz de las neoplasias. Para ello se han desarrollado en las últimas décadas técnicas de análisis masivo («tissue microarrays»), que permiten el estudio simultáneo de múltiples neoplasias en una sola sección histológica.
En nuestro estudio de nuevos factores de valor pronóstico y terapéutico en el cáncer de pulmón, hemos analizado la expresión de c-kit y EGFR, dos moléculas «dianas terapéuticas», en 40 pacientes con carcinoma de pulmón diagnosticados en nuestro hospital, utilizando inmunohistoquímica sobre matrices de tejidos.
El estudio demostró una relación entre la expresión de c-kit y los tipos histológicos adenocarcinoma y carcinoma neuroendocrino, las neoplasias localmente más avanzadas y la mayor capacidad metastatizante.
Como en otros estudios, hemos encontrado asociación entre expresión de EGFR y diferenciación escamocelular.
Palabras clave: Cáncer de pulmón, inmunohistoquímica, EGFR, c-kit.
SUMMARY
Due to the high rates of disease and death in patients with lung cancer and the lack of effectiveness of current therapy, new alternative treatments are being tried. A basic aim of current cancer research is the identification of genetic alterations involved in tumour development, and which could constitute prognostic factors, therapeutic targets for new drugs, and even prove useful for the early diagnosis of neoplasms. New tools have recently been developed for mass analysis (tissue microarrays) that allow the simultaneous study of many neoplasms in one single histological section.
In our study of new factors with possible therapeutic or prognostic value in lung cancer, we analyzed the expression of c-kit and EGFR, two «therapeutic targets», in 40 patients with lung cancer from our hospital, using immunohistochemistry on tissue arrays.
The results showed an association between the expression of c-kit and the histologic types of adenocarcinoma and neuroendocrine carcinoma, locally advanced neoplasms, and a greater capacity for metastasis.
As with other studies, we found an association between EGFR expression and squamous differentiation.
Key words: Lung cancer, immunohistochemistry, EGFR, c-Kit.
INTRODUCCIÓN
Según los datos aportados anualmente por la Sociedad Americana del Cáncer (2005) (1), el cáncer de pulmón es el segundo en incidencia y el que causa mayor mortalidad, tanto en hombres como en mujeres. El factor de riesgo principal de cáncer de pulmón es el consumo de tabaco, siendo éste responsable del 90% de los casos, tanto de forma directa como indirecta (tabaquismo pasivo), pero su etiología es multifactorial, interviniendo en ella tanto factores ambientales (polución ambiental, laboral...) como genéticos.
Los receptores tirosín quinasa constituyen una de las mayores familias de oncogenes. El c-kit y el EGFR son receptores de tipo tirosín quinasa cuya expresión está siendo estudiada actualmente en diferentes tipos de tumores. Parecen estar relacionados con la evolución de la enfermedad, indicando un peor pronóstico en los tumores que lo expresan. Además existen nuevos fármacos inhibidores, que están siendo sometidos a estudio y que podrían ser útiles para el tratamiento de distintos tumores, como el carcinoma de colon, el GIST y el cáncer de pulmón.
La unión del factor de crecimiento al dominio extracelular del receptor, permite la formación de dímeros o heterodímeros. Esto causa un cambio en la conformación del receptor, por la cual un péptido localizado en el dominio intracelular del receptor se traslada del centro activo, y así la tirosín quinasa se activa. (4) Las mutaciones de los proto-oncogenes que codifican para los receptores, hacen que se produzcan alteraciones en su configuración dando lugar a su activación permanente, no respondiendo a señales externas. Uno de los mecanismos por los que se produce esta alteración es la dimerización permanente del receptor.
También puede producirse una amplificación de los genes que codifican los receptores, produciéndose su sobreexpresión, y por tanto su activación, como parece ocurrir en el cáncer de mama con el gen que codifica el receptor erbB-2/neu.
Estas formas activadas de los receptores emiten señales de proliferación hacia el interior de la célula, independientemente de la presencia o ausencia del factor de crecimiento (3,4).
El protooncogen c-kit (CD117) está localizado en el brazo largo del cromosoma 4 (4q12), junto a al gen del PDGFR y codifica una proteína receptora tipo tirosín-quinasa de la familia del EGF, asociada a los receptores PDGF/CSF-1 (5,6).
Se expresa en diversos tipos celulares, como las células de Cajal de tracto gastrointestinal, mastocitos, células madre hematopoyéticas, células germinales, células epiteliales de la mama, melanocitos y células basales de la epidermis (5). También se ha descrito su expresión en la porción basal de los túbulos renales distales, células acinares de la parótida, astrocitos y células de Purkinje (7).
La identificación de moléculas diana, sobre todo aquellas que inhiben de forma específica los mecanismos celulares responsables del crecimiento celular, incluyendo las relacionadas con los receptores tirosín quinasa, pueden suponer la interrupción del crecimiento celular en tumores. Como otros miembros de esta familia de receptores, c-kit ha despertado un enorme interés en los últimos años, al constituir una diana terapéutica muy eficaz para inhibidores de las tirosín quinasas, como el Imatinib (Glivec®), lo que ha tenido una gran relevancia clínica en el tratamiento de determinadas neoplasias, como los tumores estromales gastrointestinales (GIST).
No existe expresión de c-kit en pulmón normal, por la tanto la expresión del mismo en tumores de origen pulmonar es aberrante (6). La expresión de c-kit en los tumores de células pequeñas de pulmón es muy variable, oscilando en los diferentes estudios entre el 21 y el 90% (8-11).
En general, los carcinomas de células no pequeñas tienen una expresión de c-kit muy limitada, sin embargo, los de diferenciación neuroendocrina, son positivos con frecuencia (12). La prevalencia de expresión de CD117 es de 77% en carcinoma neuroendocrino de células grandes (13). En este tipo tumoral, la positividad de c-kit está relacionada de forma significativa con la recidiva tumoral. Se expresa con frecuencia en este tipo de tumores y parece constituir un factor pronóstico negativo (14).
El receptor del factor de crecimiento epidérmico o EGFR, es un receptor tirosín quinasa, de la familia de receptores clase I, entre los que se encuentran el HER2/neu, HER3 y HER4, cuyo gen se localiza en el brazo corto del cromosoma 7 (7p12) (15). Su activación provoca la proliferación, diferenciación, adhesión celular y protección frente a la apoptosis. También se ha relacionado con la angiogénesis (16,17). Está relacionado con la motilidad y migración celular, y por tanto con la capacidad invasora tumoral como se ha demostrado en el cáncer de mama, en el que la sobreexpresión de EGFR provoca un incremento de la motilidad celular cuando se expone a su factor de crecimiento.
En los carcinomas de pulmón, del 43 al 89% sobreexpresa EGFR (16,18). Es más frecuente en los carcinomas escamocelulares (70%) seguido por el adenocarcinoma (50%) y es rara su expresión en carcinomas de célula pequeña (19).
Existen diferentes moléculas inhibidoras de EGFR, que se han sintetizado para el tratamiento de tumores EGFR positivos. IMC-225 o Cetuximab (Erbutix®), es un anticuerpo monoclonal quimérico (humano/ratón), cuya acción es doble: bloquea el receptor y activa la inmunidad celular citotóxica. Se ha observado que potencia los efectos citotóxicos de la quimio y radioterapia. Este anticuerpo se ha estudiado en pacientes con cáncer de colon y cáncer de cabeza y cuello, y en la actualidad se está probando en carcinomas de célula no pequeña de pulmón. Hay en marcha varios ensayos que utilizan el tratamiento combinado con IMC-225 y agentes quimioterápicos en pacientes resistentes a la quimioterapia convencional, y que sobreexpresan EGFR. Otras moléculas estudiadas, son ZD1839 o gefitinib (Iressa®) y OSI-774 o erlotinib (Tarceva®), que se unen de manera reversible al receptor, bloqueándolo.
MATERIAL Y MÉTODOS
Los 40 casos del estudio se han seleccionado de entre los carcinomas pulmonares diagnosticados en el Servicio de Anatomía Patológica del Hospital Carlos Haya de Málaga en los últimos tres años. La selección se ha basado en la disponibilidad de tejidos congelados y almacenados en el Banco de Tumores del citado Servicio. Estos tejidos congelados permitirán, en el futuro, la realización de estudios de expresión genética comparativa. Todos los pacientes han sido intervenidos en nuestro hospital, y su seguimiento ha sido llevado a cabo por los servicios de Cirugía Torácica y Oncología de dicho hospital. La información clínica de los pacientes se ha obtenido por revisión de las Historias Clínicas.
De todos los pacientes se disponía de tejidos fijados en formol e incluidos en parafina del archivo del Servicio de Anatomía Patológica. Se realizó la revisión histopatológica de los casos para confirmar los diagnósticos iniciales y seleccionar las áreas tumorales a analizar. Se consideraron válidas para el estudio las áreas tumorales representativas del tipo histológico y viables (sin necrosis). Paralelamente se seleccionaron áreas de tejido no tumoral, preferentemente del mismo bloque de tejido, que representaran la histología normal del pulmón. Tras la revisión y selección histopatológica, se elaboraron cuatro arrays de tejidos utilizando para ello el Tissue Arrayer modelo MTA1 (Beecher Instruments) que contenían 160 cilindros representando tejido neoplásico y normal de los 40 casos seleccionados (fig. 1). Se realizaron cortes finos de 3 µm de los bloques de arrays, que se colocaron sobre portas tratados (DAKO).

Fig. 1:
Cuarenta casos del estudio incluidos en cuatro
arrays de tejidos.
La detección inmunohistoquímica de c-kit se realizó en el inmunoteñidor automático Techmate 500, con el kit de detección Chemmate Detection Kit, Peroxidase/DAB (K5001 DAKO) tras desenmascaramiento antigénico por calor en olla a presión en tampón Citrato 10 mM pH 6.0 durante 2 minutos. Se utilizó el anticuerpo primario anti c-kit (CD117) policlonal de conejo anti-humano, A4502 DAKO con dilución 1/50, validado para su uso en tejidos fijados e incluidos en parafina.
Para la determinación de EGFR se empleó el kit pharm Dx® EGFR K1492 con un anticuerpo primario antiproteína EGFR monoclonal de ratón anti-humano, clon 2-18C9 DAKO prediluido, siguiendo las instrucciones del fabricante.
La inmunotinción ha sido evaluada sin conocimiento de los datos clínicos ni del informe anatomopatológico. Para ambas proteínas se ha tenido en cuenta la tinción citoplasmática y de membrana, valorándola por intensidad de tinción en: negativa, +, ++, +++. (Negativa, cuando hay ausencia de tinción, + cuando es leve, ++ si es moderada y +++ cuando la tinción es intensa) (fig. 2).
![]()
Fig. 2:
Expresión de c-kit y EGFR (+++).
En el estudio estadístico se realizaron análisis bivariantes mediante tablas de contingencia a través de las cuales se obtuvieron las razones de ventaja (OR) que dan una estimación del riesgo relativo. También se obtuvieron los intervalos de confianza para el OR a un nivel de confianza del 95%. A través de la prueba exacta de Fisher se obtuvieron los valores p. El nivel de significación exigida para los análisis es de p £ 0,05 (se asume un error del 5%).
RESULTADOS
Se seleccionaron cuarenta pacientes de entre 42 y 78 años de edad, diagnosticados de cáncer de pulmón, de los cuales treinta y cuatro eran varones y seis mujeres, todos ellos fumadores excepto tres (mujeres).
Las variables recogidas de las Historias Clínicas han sido: tamaño tumoral, tipo histológico y grado de diferenciación tumoral, estadio de la enfermedad al diagnóstico, tipo de intervención quirúrgica y tratamiento adyuvante entre otras (tabla 1). Se ha calculado el tiempo de supervivencia de los pacientes, teniendo en cuenta tan solo los fallecimientos a causa de la enfermedad, en un seguimiento que oscila entre 322 y 1726 días. Sólo se ha producido la pérdida de un paciente en el seguimiento.

Los tipos histológicos tumorales eran muy variados, incluyendo diecisiete adenocarcinomas, catorce carcinomas escamocelulares, tres tumores carcinoides, dos carcinomas indiferenciados, un carcinoma anaplásico, un carcinoma pleomórfico, un neuroendocrino de célula grande y un carcinoma de células pequeñas. Éstos han sido agrupados en cuatro categorías. La primera, denominada «célula no pequeña», incluye los carcinomas escamocelulares, adenocarcinoma e indiferenciado. La segunda, los tumores carcinoides, la tercera el carcinoma de células pequeñas y la cuarta y última («otros»), carcinoma pleomórfico, anaplásico y neuroendocrino de células grandes.
Respecto al grado de diferenciación había diecinueve tumores poco diferenciados, diez moderadamente diferenciados y once bien diferenciados.
El tamaño tumoral era de 1,1 cm el más pequeño, y 10,5 cm el mayor, y siguiendo los criterios de la OMS, actualmente aplicados para el estadiaje del cáncer de pulmón, los hemos agrupado en mayores de 3 cm o menores o iguales a 3 cm.
La mayoría de los pacientes de nuestro estudio se encontraban en un estadio tumoral Ib (diecisiete). El resto de los pacientes se distribuían de la siguiente manera: seis en estadio Ia, cinco en IIb, siete en IIIa, dos en IIIb y tres en estadio IV.
El seguimiento de nuestros pacientes fue posible en todos, excepto en uno, que no acudió a revisiones, oscilando entre 12 y 200 semanas. Dos de los pacientes murieron por complicaciones de la cirugía en el postoperatorio inmediato. Entre los 37 restantes, sólo dos han fallecido debido a la enfermedad. El resto de los pacientes siguen vivos, libres de enfermedad.
C-kit:
Un 52,5% de los casos resultaron positivos, mientras que el 47,5% no expresaron c-kit (fig. 3).

Fig. 3:
Frecuencia de expresión de c-kit en nuestra
serie.
La expresión inmunohistoquímica de c-kit en adenocarcinomas fue de un 62,5% y en carcinomas escamocelulares de un 26,7%.
En las tablas 2 y 3 se muestra el análisis de la asociación entre la expresión de c-kit (negativo, positivo) y las variables recogidas, por análisis bivariante mediante tablas de contingencia y con el test exacto de Fisher y mediante el modelo de regresión logística simple.
EGFR:
El 82,5% de los tumores expresaban EGFR, mientras que eran negativos un 17,5% (fig. 4).
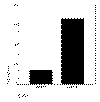
Fig. 4:
Frecuencia de expresión de EGFR en nuestra serie.
En las tablas 4 y 5 se analiza la expresión de EGFR, como se hizo con c-kit, habiendo diferencias en el caso de las variables «tabaco» y «sexo», siendo estadísticamente significativa en la segunda, de modo que los pacientes fumadores y de sexo masculino expresaban EGFR con mayor frecuencia que los no fumadores y la mujeres (p=0,07 y 0,05 respectivamente) (fig. 5 y 6).
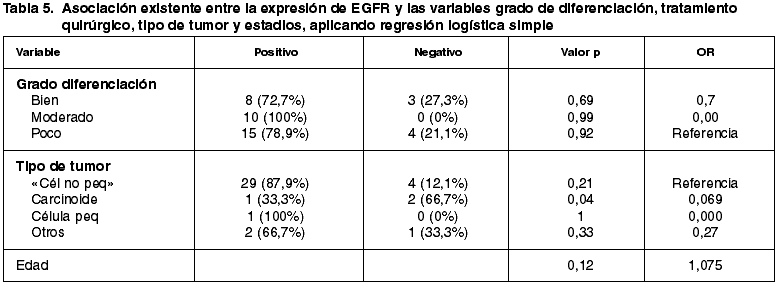

Fig. 5:
Distribución de expresión de EGFR y sexo.
Fig. 6:
Relación de expresión de EGFR y tabaco.
Había 9 casos con metástasis ganglionar (7 adenocarcinomas, un escamocelular y un pleomórfico), y todos eran positivos para EGFR. Debido al escaso número de casos con metástasis ganglionares, no fue posible realizar el test de Fisher, por lo que no podemos determinar si existe una significación estadística en la asociación EGFR-metástasis ganglionar.
DISCUSIÓN
El espectro de edad y sexo de los pacientes de nuestro estudio correspondían a lo descrito en nuestra población, con un pico de frecuencia en los 65 años. Como es habitual en nuestro medio, la mayoría de los pacientes eran varones y fumadores. Aunque se ha publicado internacionalmente un aumento en la incidencia de cáncer de pulmón en mujeres, en nuestra serie no se refleja aún esta tendencia, que probablemente se manifestará en el futuro.
En relación a la estirpe tumoral, lo que se refleja en nuestra serie corresponde a lo habitual en nuestra población, si exceptuamos los carcinomas de células pequeñas, cuyo protocolo de tratamiento no incluye la cirugía.
Respecto al grado de diferenciación y tamaño tumoral, nuestros casos mostraban gran variabilidad, como sucede habitualmente en la clínica.
El estadio tumoral que aparece con mayor frecuencia en nuestra serie es el Ib, que refleja neoplasias que no metastatizan en ganglios linfáticos y que no afectan a estructuras vecinas. En estos estadios relativamente precoces, la cirugía puede ser curativa, lo que justifica la mayor representación de este grupo de pacientes. En estadios más avanzados, la cirugía se considera paliativa y debido a su agresividad y a la alta mortalidad peroperatoria, tiende a evitarse.
El seguimiento de nuestros pacientes ha demostrado que en principio, la terapia quirúrgica ha sido curativa, ya que 35 de 39 siguen vivos y sanos al cabo de un seguimiento medio de 53 semanas. En los pacientes con carcinoma de pulmón de células no pequeñas (que en nuestro estudio son la mayoría), con enfermedad aparentemente localizada y tras resección quirúrgica, los índices de supervivencia a los 5 años oscilan entre el 25 y el 70% (19). Por lo tanto, consideramos que nuestro tiempo de seguimiento es aún corto para valorar la supervivencia de nuestros pacientes.
C-kit:
El interés que despierta el estudio de c-kit en las neoplasias humanas está justificado por su papel como diana terapéutica, válida en neoplasias como los GIST. Llevamos a cabo el estudio de la expresión de c-kit en nuestro grupo de pacientes de carcinoma de pulmón para evaluar su posible utilidad en el tratamiento y pronóstico.
Coincidiendo con la serie publicada por Micke y cols. (20), la expresión inmunohistoquímica de c-kit fue mucho más frecuente en adenocarcinomas (62,5%), que en carcinomas escamocelulares (26,7%). Estos autores detectaron un patrón de expresión casi idéntico al nuestro, lo que nos induce a pensar que pudiera ser un perfil homogéneo en estas neoplasias. Sin embargo, dado que el número de casos es relativamente pequeño, serían necesarias series más amplias para reafirmar esta asociación.
El grado de diferenciación de las neoplasias no se relacionó con la expresión de c-kit. Aunque no hemos encontrado en la literatura referencias al respecto, observamos que este factor no se asociaba a desdiferenciación, como ocurre en otras neoplasias como el cáncer de mama.
Al igual que en otros estudios no hemos encontrado correlación entre la expresión de c-kit y el estadio tumoral.
La disminución de la expresión de c-kit se ha descrito tras el tratamiento quimioterápico (21). Nuestra serie no permite analizar tal modificación, puesto que solamente dos pacientes de los incluidos en el estudio habían recibido quimioterapia preoperatoria. Uno de los casos ha resultado negativo y el otro positivo débil (+).
Podemos considerar carcinomas neuroendocrinos los tumores carcinoides, el carcinoma neuroendocrino de células grandes y el de células pequeñas. En la bibliografía revisada los carcinomas neuroendocrinos expresan con mayor frecuencia c-kit. En nuestra serie tenemos cinco casos, de los que tres expresan c-kit (60%). El número de casos es muy pequeño para sacar conclusiones de este hecho, sin embargo, la frecuencia es similar a la que se observa en el grupo de adenocarcinomas. Esta similitud no es sorprendente, ya que se han detectado otras alteraciones genéticas comunes entre adenocarcinomas y carcinomas neuroendocrinos (mutación de KRAS) (22).
El tamaño tumoral es una de las variables determinantes del pronóstico. Está descrito que los tumores que son positivos para c-kit, tienen peor pronóstico. (23) En nuestra serie hemos observado que los tumores de tamaño menor o igual de 3 cm (éste es el punto de corte que está admitido por la OMS para el estadiaje del cáncer de pulmón), tienen menor expresión de la proteína c-kit que los de mayor tamaño. Aunque quizá por el tamaño de la muestra las diferencias no han sido estadísticamente significativas, el patrón de expresión es muy llamativo, sugiriendo una asociación entre neoplasias más agresivas y la expresión de c-kit.
También son factores pronósticos esenciales la existencia de metástasis ganglionares y de metástasis a distancia. No hemos encontrado diferencias entre la expresión de c-kit y la presencia de ganglios linfáticos metastáticos. Tampoco la literatura refiere asociaciones entre las alteraciones de este oncogén y el desarrollo de metástasis ganglionares.
En relación a las metástasis a distancia, la expresión de c-kit es mayor los pacientes con metástasis en comparación con el resto de los pacientes, aunque las diferencias observadas no son estadísticamente significativas. Estos datos pueden sugerir, al igual que la asociación con el tamaño tumoral, que c-kit puede ser un factor activado en neoplasias evolucionadas.
Nuestro estudio está limitado por la forma de selección de los pacientes, ya que hemos incluido en la serie exclusivamente aquellos de los que disponemos de tejido congelado para futuros estudios genéticos. Este hecho ha determinado que sólo se hayan incluido pacientes intervenidos en los últimos tres años. El seguimiento no puede ser por lo tanto lo suficientemente largo como para elaborar curvas de supervivencia valorables y serán precisos análisis posteriores de la situación clínica de los pacientes.
Aunque nuestros resultados no aportan diferencias estadísticamente significativas entre las neoplasias que expresan o no c-kit, debido principalmente al tamaño de la muestra, sí hemos observado una relación con el tipo histológico (adenocarcinomas y carcinomas neuroendocrinos) y hemos podido detectar una cierta asociación entre la expresión de la proteína y las neoplasias localmente más avanzadas y con capacidad metastatizante. Este hecho deberá comprobarse en una serie más amplia y homogénea de pacientes.
EGFR:
La mayoría de nuestros casos (82,5%) eran positivos para EGFR, acorde con otras series (24).
Como en la mayoría de los trabajos publicados, los tipos histológicos que expresan EGFR con más frecuencia son el adenocarcinoma y el carcinoma escamocelular. En nuestro estudio eran positivos el 92,5% de los carcinomas escamocelulares y el 42,5% de los adenocarcinomas. La asociación entre expresión de EGFR y diferenciación escamocelular es aún más fuerte en nuestra serie que en las publicadas hasta el momento (25).
Este hallazgo puede explicar la elevada frecuencia de positividad para EGFR en pacientes fumadores, los cuales mayoritariamente desarrollan neoplasias con diferenciación escamosa. Esta asociación no alcanzó, sin embargo, significación estadística.
Los tumores que aparecen en los pacientes no fumadores de nuestro estudio son principalmente, tal y como se refiere en la literatura, adenocarcinomas y tumores carcinoides.
Por las mismas razones y puesto que los varones de nuestra serie son en su mayoría fumadores, hemos encontrado una clara relación entre la expresión del receptor y el sexo masculino. Nuestros resultados contrastan en este aspecto con los hallazgos de Hsieh y cols. e Isobe y cols. que detectan mayor frecuencia de mutaciones de EGFR en mujeres que en varones con adenocarcinoma, especialmente en no fumadores y variante bronquioloalveolar (26,18). En otros estudios sin embargo, muestran mayor expresión inmunohistoquímica los fumadores (27). Estas discrepancias pueden revelar diferencias en la composición de la serie de pacientes, pero también diferencias en factores carcinogénicos ambientales.
A pesar de que entre nuestros pacientes todos los tumores con metástasis ganglionares expresan EGFR, la muestra no nos permite una evaluación estadística de la asociación, que es sin embargo, llamativa.
Este estudio, aunque limitado por su tamaño y diversidad, refleja una mayor frecuencia de expresión de c-kit en neoplasias pulmonares con diferenciación glandular y neuroendocrina y en tumores de comportamiento local más agresivo y con mayor tendencia a producir metástasis a distancia. Por otro lado, la expresión de EGFR se ha observado con mayor frecuencia en neoplasias con diferenciación escamosa de pacientes varones y fumadores. Su posible asociación con otros factores de progresión tumoral requerirá el estudio de series más amplias.
BIBLIOGRAFÍA
Jemal A, Murray T, Ward E , Samuels A, Tiwari RC, Ghafoor A et al. Cancer statistics, 2005. CA Cancer J Clin 2005; 55: 10-30.
Schulz WA. Oncogenes. En: Shulz WA. Molecular biology of human cancers. Dordrecht: Springer Science, 2005. p. 71-90.
Dikic I, Szymkiewicz I, Soubeyran P. Signaling networks in the regulation of cell function.Cell Mol Life Sci 2003; 60: 1805-27.
Jaffe LF. Epigenetics theories of cancer initiation. Adv Cancer Res 2003; 90: 209-30.
Gibson PC, Cooper K. CD117 (Kit): A diverse protein with selective applications in surgical pathology. Adv Anat Pathol 2002; 9: 65-9.
Miettinen M, Lasota J. KIT (CD117): A review on expression in normal and neoplastic tissues, and mutations and their clinicopathologic correlation. Appl Immunohistochem Mol Morphol 2005; 13: 205-20.
Natali PG, Nicotra MR, Sures I, Santoro E, Bigotti A, Ullrich A. Expression of c-Kit in normal and transformed human nonlymphoid tissues. Cancer Res 1992; 52: 6139-43.
Johnson BE, Fischer T, Fischer B, Dunlop D, Rischin D, Silberman S, et al. Phase II study of imatinib in patients with small cell lung cancer. Clin Cancer Res 2003; 9: 5880-7.
Mojica WD, Saxena R, Starostik P, Cheney RT. CD117 + small cell lung cancer lacks the asp 816 val point mutation in exon 17. Histopathology 2005; 47: 517-22.
Murray N, Salvia R, Fossela FV. Tarjeted molecules in small cell lung cancer. Semin Oncol 2004; 31: 106-11.
Boldrini L, Ursino S, Gisfredi S, Faviana P, Donati V, Camacci T, et al. Expresion and mutational status of c-kit in small-cell lung cancer: prognostic relevante. Clin Cancer Res 2004; 10: 4101-8.
Butnor KJ, Burchette JL, Sporn TA, Hammar SP, Roggli VL. The spectrum of kit (CD117) immunoreactivity in lung and pleural tumors. Arch Pathol Lab Med 2004; 128: 538-43.
Pelosi G, Masullo M, Leon ME, Veronesi G, Spaggiari L, Pasini F, et al. CD117 immunoreactivity in high-grade neuroendocrine tumors of the lung: a comparative study of 39 large-cell neuroendocrine carcinomas and 27 surgically resected small-cell carcinomas. Virchows Arch 2004; 445: 449-55.
Casali C, Stefani A, Rossi G, Migaldi M, Bettelli S, Parise A, et al. The prognostic role of c-Kit protein expression in resected large cell neuroendocrine carcinoma of the lung. Ann Thorac Surg 2004; 77: 247-53.
Altuna Mariezkurrena X, Algaba Guimerá J, Wang Rodríguez J, Ongkeko W. Estudio por inmunohistoquímica de la expresión de EGFR en carcinoma de células escamosas de cabeza y cuello. Acta Otorrinolaringol Esp 2005; 55: 143-6.
Scagliotti GV, Selvaggi G, Novello S, Hirsch FR. The biology of Epidermal Growth Factor Receptor in lung cancer. Clin Cancer Res 2004; 10: 4227-32.
Vlahovic G, Crawford J. Activation of tyrosine kinases in cancer. Oncologist 2003; 8: 531-8.
Isobe T, Herbst RS, Onn A. Current management of advanced non-small cell lung cancer: Targeted Therapy. Semin Oncol 2005; 32: 315-28.
Zheng Z, Bepler G, Cantor A and Haura EB. Small tumor size and limited smoking history predicts activated epidermal growth factor receptor in early stage non-small cell lung cancer. Chest 2005; 128: 308-16.
Micke P, Hengstler JG, Albrecht HF, Faldum A, Bittinger F, Becker K, et al. C-kit expression in adenocarcinomas of the lung. Tumor Biol 2004; 25: 235-42.
Dy GK, Miller AA, Mandrekar SJ, Aubry MC, Langdon M, Morton RF, et al. A phase II trial of imatinib (ST1571) in patients with c-kit expressing relapsed small-cell lung cancer: a CALGB and NCCTG study. Ann Oncol 2005; 16: 1811-6.
Couce, ME, Bautista L, Costa J, Carter D. Analysis of K-ras, H-ras, and p53 in lung neuroendocrine neoplasm. Diagn Mol Pathol 1999; 8: 71-9.
Pelosi G, Barisella M, Pasini F, Leon ME, Veronesi G, Spaggiari L, et al. CD117 immunoreactivity in stage I adenocarcinoma and squamous cell carcinoma of the lung: relevance to prognosis in a subset of adenocarcinoma patients. Mod Pathol 2004; 17: 711-21.
Greatens TM, Niehans GA, Rubins JB, Jessurun J, Kratzke RA, Maddaus MA, et al. Do molecular markers predict survival in non-small cell lung cancer? Am J Respir Crit Care Med 1998; 157: 1093-7.
Rush V, Klimstra D, Venkatraman E, Pisters PW, Langefeld J, Dmitrowsky E. Overexpression of epidermal growth factor receptor and its ligand transforming growth factor ( is frecuent in resectable non-small cell lung cancer but does not predict tumor progression. Clin Cancer Res 1997; 3: 515-22.
Hsieh RK, Lim KH, Kuo HT, Tzen CY, Huang MJ. Female sex and bronchioloalveolar pathologic subtype predict EGFR mutations in non-small cell lung cancer. Chest 2005; 128: 317-21.
Dutu T, Michiels S, Fouret P, Penault-Llorca F, Validire P, Benhamou S, et al. Differential expression of biomarkers in lung adenocarcinoma: A comparative study between smokers and never-smokers. Ann Oncol 2005; 16: 1906-14.