
Vol. 38, n.º 3, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 3, 2005 |
REVISIÓN
Julio Escalona Zapata
Servicio de Anatomía Patológica. Sanatorio Ntra. Sra. del
Rosario. Madrid
jescalona@jazzfree.com
RESUMEN
Se revisa la última clasificación de los tumores del Sistema Nervioso propuesta por la OMS (2000) en lo referente a los oligodendrogliomas. A propósito de ello, se destacan algunas áreas dudosas o incompletas, insistiéndose en dos puntos: a) la relación entre astrocitos y oligodendrocitos y su repercusión en el concepto de oligodendroastrocitoma (tumor mixto); b) los criterios de malignidad.
Se destaca: a) el papel de la metaplasia astrocítica como causa del oligoendroastrocitoma y b) los criterios de malignidad existentes y los fenómenos de desdifenciación como causa de ella.
Palabras clave: oligodendroglioma, oligodendroastrocitoma, metaplasia astrocítica, criterios de malignidad.
SUMMARY
The last classification of tumors of the Nervous System (2000) is reviewed. In the chapter of oligodendrogliomas, two aspects have been considered; a) the relation between astrocytes and oligodendrocytes and their influence in the concept of oligodendroastrocytoma, and b) the criteria of malignancy.
The role of astrocytic metaplasia in the origin of oligodendroastrocytoma and the actual criteria of malignancy as well as the role of dedifferentiation phenomena in their origin, have been emphasized.
Key words: oligodendroglioma, oligodendroastrocytoma, astrocytic metaplasia, criteria of malignancy.
Con cierta frecuencia se considera que el especialista de una determinada rama de la Anatomía Patología es una persona que conoce los libros clásicos sobre el tema y que lee las Revistas al uso, por lo que sus conocimientos están al día. Personalmente, creemos que esto no es así. Esta persona podrá ser un erudito pero no un autentico especialista. Este último es el que, en lugar de aceptar los patrones clásicos, se plantea dudas acerca de su validez. No de otro modo, van avanzando los conocimientos.
Por ello, cuando se realiza un análisis critico de las clasificaciones, creemos que debe tenderse mas a plantear problemas, aunque, en ocasiones, haya que limitarse a plantearlos sin aportar soluciones, a veces inexistentes en la actualidad.
Muy probablemente, el diagnostico del oligodendroglioma sea no solo uno de los mas fáciles de la Neuropatología, sino de toda la Patología Tumoral. La imagen en huevo frito y su asociación en panal de abejas son tan constantes que dejan pocas dudas a resolver (fig. 1).
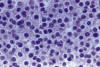
Fig. 1: H-E.
400x. Oligodendroglioma clásico. Células poligonales de núcleo redondo, central
y citoplasma claro, con neta membrana celular (imagen en huevo frito).
Asociación difusa con células adosadas unas a otras, sin apenas intersticio
(imagen en panal de abejas).
De este modo, vemos como a lo largo de las sucesivas clasificaciones de la O.M.S. se han mantenido unas subdivisiones muy similares, incluyéndose los tumores mixtos, oligodendroastrocitomas, y las formas malignas con un grado III (1,2,3).

No cabe duda de que, en comparación con anteriores ediciones, esta ultima clasificación de 2000 aporta una mayor claridad y una mejor subdivisión con variantes hasta ahora no consideradas, pero deja en el aire problemas precisamente ligados a estos dos últimos aspectos: la naturaleza de los tumores mixtos y las formas malignas. De este modo, una cifra evaluable alrededor el 10% ofrece variabilidades no contenidas en las que podríamos llamar «clasificaciones oficiales».
Un primer problema radica en el establecimiento de criterios fiables de identificación ya que el diagnostico del oligodendroglioma se ha basado en las imágenes clásicas con H-E. La falta de un marcador inmunohistoquímico especifico y la lentitud, los problemas de muestreo y la escasa especificidad de la microscopia electrónica les hacen de poco valor utilizarla con fines diagnósticos. Afortunadamente, la Biología Molecular ha venido a aportar un criterio de identificación que parece ser de máxima fiabilidad. Se trata de la perdida de la heterozigosidad en los cromosomas 19q y 1p (4,5). De su empleo se esperan aportaciones, tanto identificatorias, en especial en la profundización de la naturaleza de los tumores mixtos, como de carácter pronostico.
Aun así, la problemática de los oligodendrogliomas que no responden a la imagen clásica, se plantea inicialmente, sobre la relación entre oligodendrocitos y astrocitos normales o tumorales.
El tema comienza con el trabajo de Takei y cols para continuar con Escalona Zapata al describirse los llamados oligodendrogliomas anómalos. Entre estos tumores no usuales, destaca el llamado oligodendroglioma eosinófilo, de citoplasma panzudo, opaco y eosinófilo, capaz de expresar GFAP, mas tarde rebautizado como minigemistocito (6,7). Nosotros hemos demostrado que no se trata de fenómenos degenerativos citoplásmicos, sino de un fenómeno progresivo que se debe al desarrollo de gliofilamentos, lo que explica su persistencia en los cultivos, su eosinofilia y la expresión de GFAP (8-10) (figs. 2, 3 y 4).
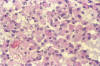
Fig. 2: H-E.
200x. Oligodendroglioma eosinófilo. Células poligonales, de núcleo lateralizado
y citoplasma eosinófilo (minigemistocitos). Asociación difusa, semejante a la
del oligodendroglioma clásico.
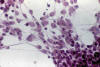
Fig. 3: H-E.
200x. Cultivo de tejidos al 21 día. Las células mantienen su morfología panzuda
y eosinófila, sobre un patrón «in vitro» de tipo oligodendroglial.
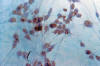
Fig. 4: GFAP.
200x. Cultivo de tejidos al 21 día. Las células emigradas expresan GFAP.
Así, la relación entre oligodendroglia y astrocitos parece ser mas intima de lo que se venia considerando sobre bases tradicionales. Inicialmente, se ha considerado que los tumores mixtos dependen de la existencia de un población celular doble que crecería variablemente mezclada (11), pero, poco a poco, han venido surgiendo criterios mas unicistas, habiéndose demostrado la doble diferenciación hacia astrocitos y oligodendroglia en cultivos de células primitivas sometidos a diferentes medios nutritivos (12,13). Igualmente se ha descrito la existencia de dos líneas celulares de origen astrocítico a lo largo del desarrollo del sistema nervioso central. Una de ellas posee antígeno Ran-2 y carece de antígeno A2B5 y daría lugar exclusivamente a astrocitos tipo I. La otra, carente de antígeno Ran-2 y que posee antígeno A2B5 podría evolucionar tanto hacia una población astrocítica (astrocitos tipo II) como oligodendroglial (14). Estos trabajos tendrían además un apoyo en la demostración de que los oligodendrocitos de la medula espinal en periodo embrionario, son capaces de expresar GFAP (15). De este modo parece que la oligodendroglia tumoral seria también capaz de expresar GFAP en los tumores derivados de esta línea celular, no solo en sus formas clásicas sino en los tumores eosinófilos y mixtos.
En el mismo sentido figura el estudio de 124 oligodendrogliomas con métodos inmunohistoquímicos, impregnaciones argénticas y cultivo de tejidos en los que se demuestra la secuencia del desarrollo de GFAP en células de morfología inequívocamente oligodendroglial hasta formarse elementos astrocitoides, bien distintos de los habítales astrocitos englobados (16,17) (figs. 5, 6, 7 y 8).
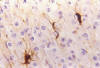
Fig. 5: GFAP.
200x. Oligodendroglioma clásico. Astrocitos atrapados en un área de infiltración
por un oligodendroglioma.
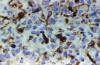
Fig. 6: GFAP.
200x. También las células tumorales oligodendrogliales expresan GFAP de forma
variable. Unas conservan su morfología clásica con citoplasma redondeado
mientras que otras emiten ya algunas expansiones.
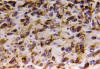
Fig. 7: GFAP
200x. La mayor parte de las células tumorales emiten ya expansiones únicas de
cierta longitud.
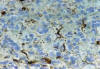
Fig. 8: GFAP.
200x. Algunas células emiten varias expansiones adoptando un cierto aspecto
astrocitoide, aunque siempre de menor tamaño.
Estos resultados han sido confirmados, al menos en parte por Kraus y cols. por medio de la Biología Molecular (5).
Como consecuencia, existe una vía de metaplasia astrocítica de las células oligodendrogliales tumorales que permite suponer que, al menos un parte de los tumores mixtos, sean consecuencia de dichos fenómenos metaplásicos en un previo oligodendroglioma o proliferación oligodendróglica.
A pesar del proverbial buen pronostico del oligodendroglioma, a lo largo de la bibliografía se han multiplicado los intentos de establecer unos criterios pronósticos fiables. Con carácter general, los criterios pronósticos pueden separarse en 3 grandes grupos (18).
Dentro de los parámetros biológicos, el sexo carece de valor y la localización tiene un valor muy relativo. La mayor sobrevida de los tumores frontales esta mas en relación con la mayor posibilidad de resecciones radicales que la del resto de los lóbulos del cerebro no frontales El propio concepto de radicalidad quirúrgica es dudoso por la capacidad del oligodendroglioma para infiltrar amplias zonas profundas del cerebro sin alterar apenas su aspecto macroscópico.
No sucede lo mismo con la edad, ya que mientras que los oligodendrogliomas de la infancia y adolescencia tienen una sobrevida media de 5 años, los tumores más agresivos se desarrollan por encima de los 55 años (19).
Ya desde un punto de vista anatomopatológico, la lista de criterios propuestos es muy amplia. En la tabla 2 se exponen los distintos criterios utilizados en la abundante bibliografía, figurando en letras mayúsculas los más valiosos y en minúsculas, los que aun habiendo sido valorados, no poseen tanta validez. Estos criterios se han utilizado tanto en estudios clásicos, como con fines estadísticos para análisis multifactoriales.

Como puede verse, sorprendentemente, en todas las series llama la atención el escaso valor de la presencia de divisiones mitósicas, siendo los mas fiables la densidad celular, polimorfía versus atipia, necrosis y aparición de células gigantes.
Continuando con los aspectos anatomopatológicos, las tasas de sobrevida han variado en relación con los avances de la clínica. En la tabla 3 se exponen los resultados obtenidos entre 1935 y 1958 y entre 1968 y 1987.
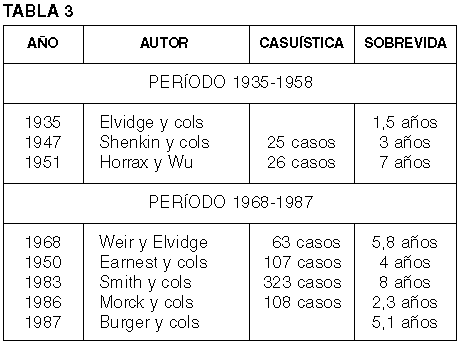
De este modo, salvo en la serie de Morck y cols, la sobrevida ha ido aumentando en relación con los progresos de la neurocirugía y, en buena parte, con el tamaño de las series estudiadas (20-27).
La consecuencia de estas revisiones es que la mayoría de los oligodendrogliomas pueden dividirse en dos grupos que se encuadrarían en los grados II y III, nunca totalmente benignos los del grupo I ni tan agresivos como los glioblastomas los del grado IV.
Algunos autores admiten más de dos grupos, pero este punto de vista esta rechazado por la mayoría. En cualquier caso, las gradaciones conllevan un cierto grado de rigidez, ya que hay tumores intermedios entre los grados II y III que difícilmente pueden encuadrarse en uno u otro grupo. No olvidemos que toda división es artificiosa y que la naturaleza no distingue compartimentos estancos, los cuales no son sino una manera de entendernos aun a sabiendas que su irrealidad. .La lista de posibles criterios es bastante amplia y ha sido utilizada no solo bajo puntos de vista clásicos, sino que han servido de base para estudios estadísticos multifactoriales. Estos criterios pronósticos se exponen en las tablas 4 y 5.


Las recidivas locales constituyen la regla en la evolución desfavorable del oligodendroglioma. Estas recidivas pueden aparecer manteniendo la misma imagen histológica o pueden mostrar imágenes de mayor agresividad tal y como se expone en la tabla 4.
Como puede verse, las cifras son muy distintas, por lo que no pueden establecerse parámetros fiables (31,32).
Igualmente las cifras de sobrevida tras la cirugía, en especial el concepto de «refección radical» deben valorarse con suma prudencia. Lo mismo puede decirse de las supervivencias tras tratamientos radioterápicos o quimioterápicos.
Sin embargo, en la bibliografía figuran dos trabajos, ya clásicos y contrarios a los postulados propuestos, que exponen un concepto del glioblastoma como una neoplasia secundaria, consecutiva no sólo a la transformación maligna de tumores astrocíticos en el sentido de Kernohan, sino de tumores ependimarios u oligodendrogliales. (28,33). A propósito de ellos, en todas las casuísticas figuran casos de glioblastomas o meduloblastomas con una evolución mas prolongada que la habitual. El caso de las figuras 9, 10 y 11 fue clasificado inicialmente como glioblastoma, y solamente gracias a un muestreo exhaustivo se pudieron encontrar imágenes que permitieron encuadrarle como un oligodendroglioma masivamente desdiferenciado (figs. 9, 10 y 11).
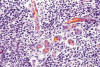
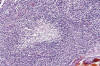
Figs. 9 y 10: H-E-
100x. Oligodendroglioma maligno. Las dos imágenes sugieren un glioblastoma en
función de su elevada densidad celular, proliferación vascular y necrosis
puntiforme.

Fig. 11: H-E.
100x Oligodendroglioma maligno. Un amplio muestreo del caso de las figuras 9 y
10, demostró la existencia de áreas claramente oligodendrogliales mezcladas en
la misma masa tumoral. No se trata de un glioblastoma, sino de un
oligodendroglioma con máxima desdiferenciación.
Estos son los casos que se beneficiaran en un futuro, casi presente, de las nuevas técnicas como la definición de la naturaleza oligodendróglica por medio de lectinas (34), el estudio de las tasas de proliferación con Ki67 o similares, y especialmente, la Biología Molecular (35). Consecuentemente, es probable que nuestros conceptos sobre este tipo de tumor varíen considerablemente en el futuro con respecto a lo que viene siendo admitido clásicamente (36).
BIBLIOGRAFÍA
Zülch KJ. Histological typing of tumors of the Central Nervous System. International Histological Classification of Tumors Geneva: World Health Organization. 1979.
Kleihues P, Burger PC, Scheithauer BW. Histological typing of tumors of the Central Nervous System. WHO Blue book, 2nd Edition Berlin: Springer. 1993.
Kleihues P, Caveneee WK. Pathology & Genetics. Tumours of the Nervous System. Lyon: IARC Press. 2000.
Reifenberger J, Reifenberger G, Liu I, James CD, Wechsler W, Collins VP. Molecular genetic analysis of oligodendroglial tumors shows preferential allelic delections on 19q and 1p. Am J Pathol 1994; 145: 1175-9.
Kraus JA, Kopman J, Kastel P, Mainz D, Brandner S, Schramm J, Louis DN, Wiestler OD, von Deimling A. Shared allelic losses of chromosomes 1p and 15q suggest a common origin of oligodendrogliomas and oligoastrocytoma. J Neuropath Exp. Neurol. 1995; 54: 91-5.
Takei Y, Mirra SS, Miles ML. Eosinophilic granular ceels in oligodendrogliomas. An ultrastructural study. Cancer 1976; 38: 1968-76.
Escalona Zapata J. Uncommon oligodendrogliomas. Acta Neuropathol Suppl (Berl). 1981; 7: 94-6.
Herpers MJHM, Budka H. Glial Fibrillary Acidic Protein in oligodendroglial tumors. Gliofibrillary oligodendroglioma and transitional oligoastrocytoma as subtypes of oligodendroglioma. Acta Neuropathol (Berlin) 1984; 64: 265-72.
Meneses ACO, Kepes JJ, Sternberger NH. Astrocytic differentiation of neoplastic oligodendrocytes. J Neuropath Exp Neurol 1982; 41: 368.
Escalona Zapata J, Cases Huerta MJ, Diez Nau MD, Lopez Martinez Bernal B. Estudio del oligodendroglioma y sus variantes por medio del cultivo de tejidos. Rev Esp Patol 2004; 37: 65-72.
Hart MN, Petito CK, Earle KM. Mixed gliomas. Cancer, 1974; 33: 134-40.
Raaf MC, Miller RH, Noble MA. A glial progenitor cell that develops «in vitro» into astrocyte or an oligodendrocyte depending of culture medium. Nature 1983; 303: 390-6.
Raaf MC, Abney ER, Miller RH. Two lineal lineages diverge prenatally in rat optic nerve. Dev Biol 1984; 106: 53-60.
De la Monte SM. Uniform lineage of oligodendrogliomas. Am J Pathol 1989; 135: 520-40.
Choi BH, Kim RC. Expression of glial fibrillary acidic protein in inmature oligodendroglia. Science 1984; 223: 407-8.
Escalona Zapata J. Astrocytes in brain tumors. Differentiation or trapping? Histol Histopathol 1994; 9: 325-32.
Escalona Zapata J, Miranda Nieves G, Gutiérrez Molina M, Martínez AM. Astrocitos en oligodendrogliomas. Estudio con impregnaciones argénticas, inmunohistoquímica y cultivo de tejidos. Rev Esp Patol 2002; 35: 533-42.
Cruz Sanchez FF, Escalona Zapata J. Prognostic Criteria of Brain Tumors. Madrid: Ed. Complutense. 1999.
Neumann J, Kimpel J, Gullotta F. Das Oligodendrogliom Neurochir 1978, 21, 35-42.
Elvidge AR, Penfield W, Cone W. The gliomas of the central nervous system. Proc Ass Res Ment Dis 1935; 16: 107-15.
Shenkin HA, Grant FC, Drew JH. Postoperative period of survival of patients with oligodendroglioma. Arch Neurol Psychiatr 1947; 58: 710-15.
Horrax G, Wu WO. Postoperative survival of patients with intracranial oligodendroglioma wih special reference to radical tumor removal. A study of 26 patients. J Neurosurg 1951; 8: 473-9.
Weir B, Elvidge AR. Oligodendrogliomas. A study of 63 cases. J Neurosurg 1968; 29: 500-5.
Earnest F, Kernohan JW, MckCraig W. Oligodendrogliomas. Arch Neurol Psychiatr 1950; 63: 964-76.
Smith MT, Ludwig CL, Godfrey AD, Armbrustmacher VW. Grading of oligodendroglioma Cancer 1983; 52: 2107-14.
Morck SJ, Halvorsen TB, Lindegaard KF, Eide GE. Oligodendroglioma. Histologic evaluation and prognosis. J Neuropath Exp Neurol 1986; 45: 65-78.
Burger PC, Rawlings CE, Cox EB, McLendon RE, Schold SC, Bullard DE. Clinicopathological correlations in the oligodendrogliomas. Cancer 1987; 59: 1345-52.
Ringertz N. Grading of gliomas. Acta Pathol Microbiol Scand 1950; 27: 51-64.
Wislawski J. Cerebral oligodendrogliomas. Clinical manifestations, surgical treatment and histological findings in seventy cases. Pol Med J 1970; 9: 162-72.
Ludwig CL, Smith MT, Godfrey AD, Armbrustmacher WA. A clinicopathological study of 323 patients with oligodendrogliomas. Ann Neurol 1986; 19: 15-21.
Vazquez JJ, Beitrag zur Pathologie der Gliomrezidive. Zbl Neurochir 1966; 27: 1-19.
Escalona Zapata J. Tumores del sistema nervioso central. Madrid: Ed. Complutense. 1996.
Henschen F. Tumoren des Zentralnervensystems und seiner Hüllen. En: Henke-Lubarsch: Handb spez. Path. Anat. Hist. 13/3. Berlin: Springer. 1955.
Figols J, Cervos-Navarro J, Cruz Sanchez FF. Lectins: reliable differentiation markers in human oligodendrogliomas. Brain Tumor Pathol 1993; 10: 1-6.
von Deimling A. Oligodendroglial tumors. Impact of molecular analysis on diagnosis and treatment. Reunion anual de S.E.N. Barcelona. 2004.
Burger PC. What is an oligodendroglioma? Brain Path 2002; 12: 257-9.