
Vol. 38, n.º 2, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 2, 2005 |
CASUÍSTICA
Javier Salamanca, Miguel Ángel Martínez-González, Claudio Ballestín
Departamento de Anatomía Patológica. Hospital Universitario 12
de Octubre, Madrid.
mmartinez.hdoc@salud.madrid.org
RESUMEN
El mixofibroma odontogénico es un tumor infrecuente de origen controvertido que de forma típica aparece en la mandíbula o el maxilar superior. Presentamos el caso de una mujer de 23 años sometida a una hemimaxilectomía izquierda por un mixofibroma odontogénico de 7 ´ 6,5 ´ 4 cm de tamaño. Microscópicamente el tumor estaba constituido por una proliferación de células estrelladas o fusiformes dispuestas de forma dispersa en una matriz mixoide. La inmunohistoquímica demostró una intensa positividad para vimentina y positividad heterogénea para actina músculo liso-específica (1A4), actina muscular específica (HHF-35) y calponina, mientras que la desmina, caldesmón, proteína S-100, HBME-1 y las panqueratinas (AE1-AE3) fueron todas ellas negativas. El microscopio electrónico reveló la existencia de células ultraestructuralmente similares a miofibroblastos. El conjunto de los resultados obtenidos sugiere un origen miofibroblástico para esta lesión, como ya ha sido referido en la literatura. Se discute el diagnóstico diferencial.
Palabras clave: mixofibroma odontogénico, mixoma, fibromixoma, maxilar.
SUMMARY
Background: Odontogenic myxofibroma is a rare benign neoplasm of controversial origin, typically developing in jawbones. Patients and Methods: A 23-year-old female subjected to left hemimaxillectomy for a maxillary myxofibroma is reported. The tumor measured 7 X 6,5 X 4 cm in diameter. Results: Microscopically, the tumor consisted of a few uniform star-shaped or spindle-shaped cells in a myxoid matrix. A prominent positivity for vimentin and scattered immunoreactivity for alpha smooth muscle actin (1A4), common muscle actin (HHF-35) and calponin was found. Desmin, caldesmon, S-100 protein, HBME-1 and cytokeratins AE1-AE3 were negative. By electron microscopy only cells with myofibroblastic morphologic features were found. Conclusion: These results suggest a myofibroblastic origin for this neoplasm as described in previous reports. Differential diagnostic possibilities are also discussed.
Key words: odontogenic myxofibroma, myxoma, fibromyxoma, jaws.
INTRODUCCIÓN
El mixofibroma odontogénico es una lesión infrecuente de naturaleza benigna y origen controvertido que aparece en el esqueleto facial, afectando con mayor frecuencia a la mandíbula. Ocurre principalmente en la segunda y tercera décadas de la vida y afecta de igual modo a ambos sexos. Generalmente crece de forma lenta y, aunque clínicamente suele ser asintomático, puede cursar con dolor y deformidad facial. Presentamos el caso de un mixofibroma odontogénico maxilar y revisamos las características clínicopatológicas, inmunohistoquímicas y ultraestructurales de este cuadro, que sugieren un origen miofibroblástico.
HISTORIA CLÍNICA
Paciente de sexo femenino de 23 años de edad con antecedentes de mononucleosis que es remitida a nuestro hospital para valoración de una tumoración en el seno maxilar izquierdo. A la exploración, la enferma presentaba una deformidad en el fondo del vestíbulo superior izquierdo con abombamiento hemifacial, proptosis y distopia del globo ocular izquierdo, así como clínica de obstrucción nasal por ocupación de fosa nasal izquierda. En la TAC de senos paranasales se objetivó una masa de aspecto tumoral en el seno maxilar izquierdo que se realzaba con contraste y se expandía adelgazando y rompiendo las paredes del seno, con extensión hacia la fosa nasal, etmoides, seno esfenoidal y órbita ipsilaterales, ocasionando exoftalmos y cruzando la línea media hacia la fosa nasal contralateral (fig. 1, izquierda).
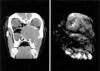
Fig. 1: A
la izquierda, TAC de senos paranasales mostrando una lesión radiolúcida en seno
maxilar izquierdo que se expande a las estructuras adyacentes. A la derecha,
imagen macroscópica de la pieza quirúrgica donde se observa una tumoración
sólida y circunscrita en seno maxilar.
Se realiza biopsia de la lesión y, un mes más tarde, la paciente es intervenida quirúrgicamente, realizándose una extirpación del tumor incluyendo maxilectomía izquierda, resección del suelo y pared medial orbitarios, vaciamiento infratemporal anterior con pterigoidectomía y legrado del seno esfenoidal. Dos años y seis meses después de la operación la paciente se encuentra bien, sin signos de recidiva tumoral.
MATERIAL Y MÉTODOS
Se recibió una pieza de maxilectomía ampliada izquierda de 5,5 ´ 4 ´ 3 cm que presentaba, por encima del paladar, una formación de aspecto tumoral de 7 ´ 6,5 ´ 4 cm de tamaño, bien delimitada y de consistencia firme, que ofrecía una superficie externa lisa y de coloración grisácea (fig. 1, derecha). La superficie de corte mostraba un color blanco-grisáceo, consistencia blanda y un característico aspecto mixoide que alternaba con áreas de apariencia más sólida. Se tomaron muestras representativas que fueron fijadas en solución tamponada de formalina al 10%, incluidas en parafina, procesadas rutinariamente y teñidas con hematoxilina-eosina. Además, se seleccionaron cortes para realización de las tinciones especiales de tricrómico de Masson, azul Alcian a pH 2,5, hierro coloidal y ácido periódico de Schiff (PAS). Muestras fijadas en formol fueron refijadas en glutaraldehído para su posterior estudio con microscopía electrónica. Por último, se realizaron técnicas de inmunohistoquímica (tabla 1) empleando los siguientes antisueros: panqueratina AE1-AE3, vimentina, actina 1A4, actina HHF-35, calponina, caldesmón, desmina, proteína S-100, antimesotelio, CD34 y colágeno IV, usando un sistema estreptoavidina-biotina-peroxidasa complex (LSAB) (DAKO, Glostrup, Dennmark) y un aparato de tinción automático (Tech Mate 500, DAKO).
RESULTADOS
Microscópicamente se trataba de una lesión bien delimitada, de crecimiento expansivo y escasamente celular, constituida por células fusiformes o estrelladas dispuestas en una matriz predominantemente mixoide que contaba con un escaso número de vasos de pequeño calibre y con un discreto infiltrado inflamatorio linfocitario acompañante (fig. 2). En algunas zonas, la lesión presentaba áreas más colagenizadas. A mayor aumento, las células mostraban un núcleo uniforme, ovoideo e hipercromático, alguno de ellos con nucleolo patente (fig. 3). No se observaron elementos de hábito epitelial odontogénico, atipia ni figuras de mitosis. Con técnicas especiales, la sustancia extracelular se teñía intensamente con hierro coloidal y Azul Alcian a pH 2,5, pero no con el PAS. Con el tricrómico de Masson se hacían evidentes áreas con mayor densidad de fibras colágenas. Inmunohistoquímicamente (tabla 1), las células mostraban un fenotipo fibroblástico-miofibroblástico con intensa positividad para vimentina y, de forma heterogénea, también para actina 1A4, actina HHF-35 y calponina (fig. 4). La lesión resultó negativa para panqueratinas (AE1-AE3), desmina, caldesmón, proteína S-100, antimesotelio y colágeno IV. El CD34 fue positivo exclusivamente en vasos y negativo en el resto El estudio por microscopía electrónica demostró una proliferación de células aisladas, inmersas en una amplia matriz en la que alternaban áreas mixoides con zonas moderadamente colagenizadas. Las células neoplásicas eran fusiformes u ovoideas con prolongaciones dendríticas (fig. 5) y mostraban en superficie revestimiento segmentario por una lámina finamente granular compatible con fibronectina, sin que se evidenciase lámina basal, pinocitosis relevante ni uniones (fig. 6, izquierda), no se encontraron fibronexos. El citoplasma subplasmalemal mostraba haces de filamentos finos con placas de anclaje (fig. 6, derecha) y moderado desarrollo del retículo endoplásmico rugoso que se disponía en finas cisternas de contenido inespecífico (fig. 5 y fig. 6, izquierda). Los núcleos eran ovoideos con escasa heterocromatina adosada a la membrana y con nucleolos visibles en el 10% de las secciones.

Fig. 2: Microscópicamente,
la lesión se caracteriza por células estrelladas o fusiformes embebidas en un
abundante estroma mixoide (original, HE x 100).
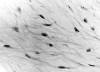
Fig. 3: A
mayor aumento, las células muestran un núcleo ovoideo e hipercromático, algunas
con nucleolo evidente (original, HE x 400).
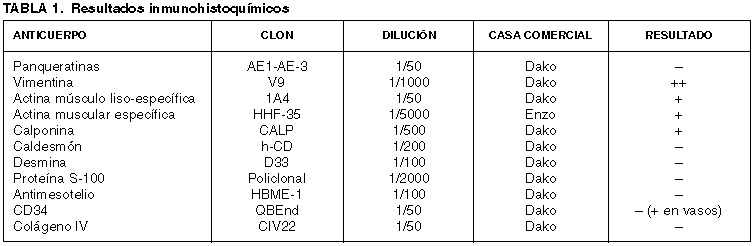
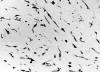
Fig. 4: Las
células tumorales eran inmunoreactivas para calponina (original, calponina x
100).

Fig. 5: Imagen
de microscopía electrónica que muestra células fusiformes e irregularmente
ovoideas con prolongaciones dendríticas (ME x 6.900).
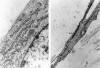
Fig. 6: A
la izquierda, detalle de una célula neoplásica con densificaciones de la
membrana celular parcialmente revestida por material finamente granular
compatible con fibronectina. Nótese el moderado desarrollo de retículo
endoplásmico rugoso (ME x 32.000). A la derecha, detalle de una célula
neoplásica con abundantes haces de filamentos finos anclados en la membrana
celular (ME x 9.600).
DISCUSIÓN
El mixofibroma odontogénico es una neoformación benigna bastante infrecuente (1-3% de los tumores mandibulares) (1) que se da con mayor frecuencia en la segunda y tercera décadas (2-6), siendo rara antes de los 10 años y después de los 50. La incidencia en varones y mujeres es similar (5,7), aunque en algunas series existe un mayor número de casos en estas últimas (8,9). Se localiza con más frecuencia en la mandíbula que en el maxilar superior (5,7-10) y sobre todo en la región posterior. La histogénesis de esta lesión es controvertida. Aunque algunos autores proponen un origen óseo, la teoría más aceptada por la mayoría es que se desarrolla a partir del componente mesenquimal del aparato dental, especialmente de la papila (3,4). Para estos últimos, los mixofibromas localizados fuera del esqueleto maxilofacial serían en realidad tumores condrales o sarcomas con extensas áreas de degeneración mixomatosa (11,12). Los datos en que se apoyan ambas teorías aparecen reflejados en la tabla 2. La mayor parte de los autores acepta que se trata de un tumor con diferenciación miofibroblástica (9,13) y nuestros hallazgos están en línea con esta hipótesis (véase más abajo). Clínicamente suele tratarse de lesiones asintomáticas, de crecimiento lento y localmente invasivas. En estadíos avanzados pueden producir dolor, parestesias, desplazamiento de piezas dentarias y deformidad facial. En el maxilar superior pueden invadir la órbita produciendo proptosis, diplopía y disminución de la agudeza visual, o bien ocasionar obstrucción del flujo aéreo por ocupación de fosas nasales, como en el caso que presentamos. Radiológicamente son lesiones radiolúcidas, uni o multiloculadas, que pueden estar bien o mal delimitadas del hueso adyacente y presentan una fina trabeculación. A veces tienen un ribete esclerótico (10,14,15). La imagen se ha descrito clásicamente como «en panal de abeja» o «en pompas de jabón». Con frecuencia producen desplazamiento de piezas dentarias y resorción de la raíz del diente afecto. Pueden infiltrar partes blandas hasta el punto de resultar difícil precisar donde se origina. Microscópicamente se trata de neoplasias con un abundante estroma mixoide constituido por mucopolisacáridos ácidos (4,16-18) que, como en el presente caso, se ponen de manifiesto con hierro coloidal y azul Alcian a pH 2,5. Prout y Hodson (17,18) determinaron que el 80% de estos mucopolisacáridos estaban constituidos por ácido hialurónico y, el 20% restante, por condroitín sulfato. En el seno de este estroma mixoide se encuentran, de manera dispersa, células pequeñas de morfología redonda o estrellada. Estas células no muestran atipia citológica ni figuras de mitosis y, aunque a veces se observan núcleos bizarros de mayor tamaño (7,12), hasta donde nosotros sabemos no se ha descrito ningún caso con transformación maligna ni metástasis regionales o a distancia. En ocasiones se observan nidos de epitelio odontogénico (7,9,19,20), aunque su presencia no es necesaria para el diagnóstico (5). La existencia de áreas con fibras colágenas en las que las células adoptan una morfología más fusiforme ha llevado a denominar a estas lesiones con el término de mixofibroma odontogénico. Se han descrito casos con focos de metaplasia ósea (4). Desde el punto de vista inmunohistoquímico, la positividad de las células tumorales para vimentina apunta a un origen mesenquimal para esta lesión. Este resultado, al igual que la expresión de actina músculo-específica y la negatividad para desmina, proteína S-100 y queratinas halladas en nuestro caso, están en consonancia con los resultados obtenidos en otras series (9,13,21,22), a excepción de la positividad para la proteína S-100 observada en los dos casos publicados por Lombardi (21). La calponina y el caldesmón son dos antisueros que marcan las células musculares lisas y, en el caso de la calponina, también los miofibroblastos. En nuestro caso, el hecho de que únicamente la primera haya resultado positiva, apoya la naturaleza miofibroblástica de la lesión. Otros antisueros empleados por los distintos autores en sus respectivos trabajos fueron NSE, NF, GFAP y FVIII-AG, para los que las células tumorales fueron negativas. Existen pocas publicaciones del aspecto ultraestructural del mixofibroma odontogénico; las más antiguas se limitan a la descripción de las células (4,5) aunque las imágenes sugieren que se trata de miofibroblastos; Lo Muzio (9), en una descripción global de 5 de sus casos estudiados por microscopía electrónica, acepta un origen fibroblástico aunque no describe detenidamente la membrana celular y presenta imágenes a gran aumento con figuras de pinocitosis que podrían sugerir diferenciación hacia músculo liso. Moshiri (13) muestra imágenes muy similares a las de nuestro caso y, basándose en el estudio ultraestructural, sugiere que la lesión es de origen miofibroblástico. En nuestro caso el marcado desarrollo del retículo endoplásmico rugoso, junto con la presencia de filamentos finos con placas de anclaje y el revestimiento segmentario de la membrana celular por material sugestivo de corresponder a fibronectina, incluso en ausencia de fibronexos, cumplen los criterios aceptados para identificar miofibroblastos (23) o al menos fibroblastos mioides, admitidos como una forma intermedia de su maduración (24). El diagnóstico diferencial se plantea fundamentalmente con quistes, el ameloblastoma, el granuloma reparativo de células gigantes, la displasia fibrosa y el quiste óseo aneurismático. La radiología es de escasa utilidad para distinguirlos del mixofibroma (2,8) porque, al igual que éste, también pueden mostrar una imagen «en panal de abeja», desplazar piezas dentarias, erosionar la raíz de los dientes afectos e invadir partes blandas. No obstante, todas estas entidades ofrecen características histológicas distintivas que permiten diferenciarlos del mixofibroma con cierta facilidad. Otros tumores mixoides como el liposarcoma mixoide, el condrosarcoma mixoide, el fibroma condromixoide y el neurofibroma mixoide también deben ser tenidos en cuenta. El liposarcoma mixoide muestra una mayor vascularización, con capilares finos que adoptan una típica disposición en «alambre de gallinero». Además, presentan positividad citoplasmática y nuclear para S-100. La identificación de lipoblastos es un hallazgo de gran ayuda. El condrosarcoma mixoide es un tumor excepcional en el esqueleto craneofacial y, a diferencia del mixofibroma, presenta un patrón de crecimiento multinodular y positividad para S-100. El fibroma condromixoide es un tumor lobulado que de forma típica muestra hipocelularidad en el centro de los lóbulos e hipercelularidad en la periferia. Por último, la intensa positividad para S-100 del neurofibroma mixoide permite distinguirlo del mixofibroma. En conclusión, antes de diagnosticar un mixofibroma odontogénico, es preciso realizar un minucioso estudio histológico de la lesión para tratar de descartar otras patologías de peor pronóstico. Finalmente, el tratamiento depende del tamaño y del grado de infiltración del tumor, pudiendo realizarse desde un simple curetaje en las lesiones de pequeño tamaño, hasta resección local o resección en bloque con reconstrucción posterior en los tumores más grandes o de límites imprecisos. En cualquier caso, debe realizarse un seguimiento estrecho del paciente durante varios años.

BIBLIOGRAFÍA
Regezi JA, Kerr DA, Courtney RM. Odontogenic tumors: analysis of 706 cases. J Oral Surg 1978; 36: 771-8.
Prein J, Remagen W, Spiessl B, Uehlinger E. Odontogenic myxoma and fibroma. En: Atlas of tumors of the facial skeleton. New York, NY: Springer-Verlag NY Inc. 1985. p. 27-31.
Rosai J. Mandible and maxilla. En: Rosai J, editor. Ackerman’s surgical pathology. 8th ed. St Louis: Mosby; 1996. p. 257-88.
Westwood RM, Alexander RW, Bennett DE. Giant odontogenic myxofibroma. Report of a case with histochemical and ultrastructural studies and a review of the literature. Oral Surg Oral Med Oral Pathol 1974; 37: 83-92.
White DK, Chen SY, Mohnac AM, Miller AS. Odontogenic myxoma – a clinical and ultrastructural study. Oral Surg Oral Med Oral Pathol 1975; 39: 901-17.
Gorlin RJ, Chaudhry AP, Pindborg JJ. Odontogenic tumors; classification, histopathology and clinical behavior in man and domesticated animals. Cancer 1961; 14: 73-101.
Zimmerman DC, Dahlin DC. Myxomatous tumors of the jaws. Oral Surg Oral Med Oral Pathol 1958; 11: 1069-80.
Abiose BO, Ajagbe HE, Tomas O. Fibromyxomas of the jawbones – a study of the 10 cases. Br J Oral Maxillofac Surg 1987; 25: 415-21.
Lo Muzio L, Nocini P, Favia G, Procaccini M, Mignogna MD. Odontogenic myxoma of the jaws: a clinical, radiologic, immunohistochemical, and ultrastructural study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996; 82: 426-33.
Allen PS. Fibromyxoma of the mandible: case report and radiographic considerations. J Am Dent Assoc 1980; 101: 930-1.
Lichtenstein, L. Bone Tumors. 4th ed. St. Louis: The C. V. Mosby Company; 1972. p. 10-11, 66-7.
Dahlin DC, Unni KK. Odontogenic and related tumors. En: Dahlin DC, Unni KK editores. Dahlin’s bone tumors: general aspects and data on 11,087 cases, 5th ed. Philadelphia: Lippincott-Raven; 1996. p. 433-47.
Moshiri S, Oda D, Worthington P, Myall R. Odontogenic myxoma: histochemical and ultrastructural study. J Oral Pathol Med 1992; 21: 401-3.
Oliver DS, DiNardo LJ, Monahan M, Kay S, Kuta AJ. Pathologic quiz case 2. Odontogenic fibromyxoma. Arch Otolaryngol Head Neck Surg 1995; 121: 805-7.
Schmidseder R, Groddeck A, Scheunemann H. Diagnostic and therapeutic problems of myxomas of the jaw. J Maxillofac Surg 1976; 6: 281-6.
Sedano HO, Gorlin RJ. Odontogenic Myxoma: some histochemical considerations. Arch Oral Biol 1965; 10: 727-9.
Prout RES, Hodson JJ. Analysis of the mucopolysaccharide of a myxoma of the mandible. Nature 1968; 218: 99-100.
Hodson JJ, Prout RES. Chemical and histochemical characterization of mucopolysaccharides in a jaw myxoma. J Clin Pathol 1968; 21: 582-9.
Tsukinoki K, Yasuda M, Shigamura K, Osamura RY, Goto J, Itoh J, Watanabe Y. Odontogenic myxofibroma arising in an elderly male: cell kinetics of epithelium and stroma. Histopathology 1999; 35: 280-1.
Gorlin RJ, Meskin LH, Brodey R. Odontogenic tumors in man and animals: pathologic classification and clinical behavior. A review. Ann N Y Acad Sci 1963; 108: 722-71.
Lombardi T, Kaffer R, Bernard JP, Fiore-Donno G, Samson J. Immunohistochemical staining for vimentin filaments and S-100 protein in myxoma of the jaws. J Oral Pathol 1988; 17: 75-7.
Green TL, Leighty SM, Walrers R. Immunohistochemical evaluation of oral myxoid lesions. Oral Surg Oral Med Oral Pathol 1992; 73: 469-71.
Schürch W, Seemayer TA, Gabbiani G. The myofibroblast. A quarter century after its discovery. Am J Surg Pathol 1998; 22: 141-7.
Eyden B. Electron microscopy in the study of myofibroblastic lesions. Seminars in Diagnostic Pathology 2003; 20: 13-24.