
Vol. 38, n.º 1, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 1, 2005 |
CASUÍSTICA
Natalia García Gómez1, Manuel Beltrán Ruiz-Henestrosa, José María Báez Perea, María José Añón Requena, Susana García Gómez2, Pilar Cabello Torres
Servicio de Anatomía Patológica del Hospital
Universitario «Puerta del Mar». Cádiz.
1 Dpto. de Biología Celular y Anatomía Patológica. Facultad de
Medicina. Universidad de Cádiz.
2 Dpto. de Anatomía Humana. Facultad de Medicina. Universidad
Complutense de Madrid.
natalia.garcia@uca.es
RESUMEN
Introducción: La coexistencia de un adenocarcinoma gástrico y un linfoma gástrico primario fue descrito por primera vez en 1931. Material y Metodos: Presentamos un caso en una paciente de 40 años con epigastralgia y perdida de peso. La gastroscopia muestra un engrosamiento de pliegues gástricos. Se realiza gastrectomía total. Resultados: El examen histológico muestra un adenocarcinoma de patrón difuso con presencia de células en anillo de sello en el seno de un infiltrado linfoide denso y difuso con presencia de típicas lesiones linfoepiteliales. Conclusiones: La presentación simultanea de un adenocarcinoma gástrico y un linfoma tipo M.A.L.T en un mismo paciente es muy infrecuente, siendo la infección por Helicobacter pylori un factor etiopatogénico en el desarrollo de ambas neoplasias.
Palabras clave: linfoma gástrico, adenocarcinoma gástrico, Helicobacter pylori, tejido linfoide asociado a mucosas.
SUMMARY
Background: A case of simultaneous gastric adenocarcinoma and primary gastric lymphoma was first described in 1931. Methods: The case we describe corresponds to a 40 year-old patient suffering from epigastralgia and loss of weight. The gastroscopy shows thickened gastric folds. A complete gastrectomy is performed. Results: The histological examination shows an adenocarcinoma with a diffuse pattern presenting signet ring cells in the core of a dense and diffuse lymphoid infiltrate, which also presents typical lymphoepithelial lesions. Conclusions: The case of simultaneous gastric adenocarcinoma and mucous associated lymphoid tissue lymphoma in a patient is very infrequent. The infection by Helicobacter Pylori is an etopathogenic factor in the development of both neoplasms.
Key words: gastric lymphoma, gastric adenocarcinoma, Helicobacter Pylori, mucosa associated lymphoid tissue.
INTRODUCCIÓN
La coexistencia de linfoma y adenocarcinoma gástricos primarios en el mismo paciente es un suceso extremadamente infrecuente (1-3).
Entre los tumores gástricos malignos primarios, el adenocarcinoma es con diferencia el más frecuente mientras que el linfoma gástrico primario supone aproximadamente del 3 al 4 % de la totalidad. La presencia simultánea de ambos tipos de tumores ha sido poco tratada en la literatura siendo en 1931 cuando Schuback y cols. publicaron el primer caso de coexistencia de ambos tipos de tumores en el mismo paciente.
El linfoma B tipo MALT de bajo grado es el linfoma gástrico que más frecuentemente se observa en estos casos, no apreciándose un claro predominio entre los tipos de adenocarcinoma gástrico (tipos de Lauren) (4).
PRESENTACIÓN DEL CASO
Mujer de 40 años de edad que acude a consulta ambulatoria por presentar un cuadro de pérdida de peso y malestar general inespecífico de 6 meses de evolución. En el último mes epigastralgia continua de mediana intensidad de predominio postprandial, acompañada de anorexia. Anemia ferropénica desde hace 7 años. Por endoscopia se aprecian en fondo y cuerpo gástrico pliegues engrosados que se biopsiaron en cuyos fragmentos se diagnosticó adenocarcinoma infiltrante multifocal tipo difuso y posible linfoma de células pequeñas en el contexto de una gastropatia hipertrófica. Se realizó gastrectomía total.
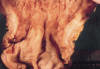
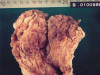
Figs. 1 y 2. Imágenes
macroscópicas de la mucosa gástrica cuya superficie es rugosa, mamelonada y con
pliegues engrosados en fundus y cuerpo, que respeta antro.
El examen macroscópico de la mucosa gástrica a nivel del fondo y cuerpo muestra una superficie difusamente rugosa y mamelonada con pliegues engrosados. Al corte se aprecia pérdida de la estratificación parietal a expensas de una superficie blanquecina en mucosa y submucosa con finos tractos blanquecinos que atraviesan la muscular propia alcanzando la serosa.
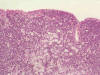
Fig. 3. Visión
conjunta del linfoma tipo M.A.L.T. y Adenocarcinoma gástrico.
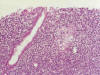
Fig. 4. Lesión
linfoepitelial, típica del linfoma tipo M.A.L.T.
El examen microscópico revela en mucosa y submucosa una densa y difusa población linfocitaria que en profundidad alcanza la serosa del órgano constituida por elementos celulares de pequeño tamaño de aspecto centrocitoide con expresión positiva para CD20 y negativa para CD5, CD10, CD23, CD43 y ciclina D1, que alternan con linfocitos reactivos y a nivel periférico con folículos linfoides con centros germinales. Se observan lesiones linfoepiteliales. Ni en los fragmentos biopsiados ni en la mucosa gástrica de la pieza quirúrgica se encontró Helicobacter pylori. La mucosa antral está respetada.
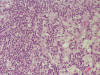
Fig. 5. La
imagen microscópica muestra la coexistencia de una proliferación linfocitaria y
de células tumorales en anillo de sello.
En el seno de dicha población linfocitaria, con criterios histopatológicos de linfoma B tipo MALT de bajo grado, se evidencian frecuentes focos de adenocarcinoma tipo difuso con células en anillo de sello que infiltra la pared gástrica hasta alcanzar la serosa del órgano. A nivel de ambas curvaduras gástricas se aislan frecuentes ganglios linfáticos con afectación simultánea por linfoma de células pequeñas y por adenocarcinoma con células en anillo de sello.
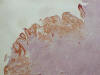
Fig. 6. La
tinción de Citoqueratina es positiva en las células tumorales del
adenocarcinoma.
La mucosa gástrica presentó en el fondo y cuerpo una superficie difusamente rugosa y mamelonada con pliegues engrosados. Al corte se aprecia pérdida de la estratificación parietal a expensas de una superficie blanquecina en mucosa y submucosa con finos tractos blanquecinos que atraviesan la muscular propia alcanzando la serosa.
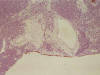
Fig. 7. Obsérvese
la infiltración del linfoma hasta la serosa gástrica, la cual es positiva para
tinción de Citoqueratina.
DISCUSIÓN
Publicaciones recientes revelan que este tipo de simultaneidad tumoral no es una simple asociación del azar, sino que la acción por infección del Helicobacter pylori juega un papel etiopatogénico destacable aunque su presencia en los cortes histológicos, sobretodo de piezas de gastrectomia, no se ponga de relieve (1,2,4-7) .El riesgo de padecer una neoplasia gástrica es mayor cuanto mas tiempo se padece la infección por Helicobacter pylori.(2)
Dentro de dicha simultaneidad tumoral se sugiere que en muchos de los casos observados, el linfoma precede a la carcinogénesis debido al tamaño de la lesión, la cual es mayor en el caso de los linfomas y que el grado de invasión en los linfomas es mas profunda en los linfomas respecto a los adenocarcinomas (1).
Es frecuente, ante la existencia de un linfoma gástrico primario, la presencia a nivel epitelial de cambios displásicos de graduación variable, debiéndose descartar en estos casos la presencia de criterios reveladores de malignidad epitelial puesto que el adenocarcinoma va a jugar un papel mas influyente en el pronóstico del paciente. Asimismo, no se debe sobrediagnosticar adenocarcinoma tipo difuso ante la sola presencia, a veces abundante de células en anillo de sello tipo globoide cuando tan sólo están presentes a nivel superficial en las areas linfomatosas tipo MALT y con ausencia de células epiteliales atípicas más pequeñas, anfófilas de localización más profunda. Dichas células epiteliales tipo globoide no son carcinomatosas sino que se desprenden de glándulas afectadas por lesiones linfoepiteliales causadas por infiltración del epitelio foveolar por linfocitos centrocitoides del linfoma tipo MALT adyacente.
BIBLIOGRAFÍA
Nakamura S, Aoyagi K, Iwanaga S, Yao T,Tsuneyoshi M, Fujishima M. Synchronous and metachronous primary gastric lymphoma and adenocarcinoma:a clinicopathologic study of 12 patients. Cancer 1997; 79: 1077-85.
Kaffes A, Hughes L, Hollinshead J, Katelaris P. Synchronous primary adenocarcinoma, mucosa-associated lymphoid tissue lymphoma and a stromal tumor in a Helicobacter pylori-infected stomach. J Gastroenterol Hepatol 2002; 17: 1033-6.
Cammarota G, Larocca L.M., D’Ugo D, Persiani R, Cianci R, Nocente Picciocchi A, Gasbarrini G. Synchronous gastric adenocarcinoma and MALT lymphoma patient with H. Pylori infection. Could the two neoplasms share common pathogenesis? Hepatogastroenterology 2001; 48: 104-6.
Goteri G, Ranaldi R, Rezai B, Baccarini MG, Bearzi I. Synchronous Mucosa-Associated Lymphoid Tissue Lymphoma and Adenocarcinoma of the Stomach. Am J Surg Pathol 1997; 21: 505-9.
Wothersponn A.C.& Isaacson P.G. Synchronous adenocarcinoma and low grade B-cell lymphoma of mucosa associated lymphoid tissue (MALT) of the stomach. Histopathology 1995; 27: 325-31.
Hardman W.J.3rd, Gal AA, Pascal RR. Gastric adenocarcinoma and low-grade B-lymphoma of mucosa-associated lymphoid tissue. South Med J. 1997; 90: 426-30.
Zamboni G, Franzin G, Scarpa, A, Bonetti F, Pea M, Mariuzzi GM, Menestrina F. Carcinoma-like Signet-ring Cells in Gastric Mucosa–associated Lymphoid Tissue (MALT) Lymphoma. Am J Surg Pathol 1996; 20: 588-98.