
Vol. 37, n.º 4, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 4, 2004 |
Laura Castellano, Rosina Smit, Pablo Lespi
Hospital «Dr. J. Penna», Laínez 2501. Bahía Blanca (CP 8000), Buenos Aires, Argentina. lauranidiaar@yahoo.com.ar
RESUMEN
El carcinoma de células basales (CCBs) es el tumor cutáneo más frecuente y parece estar originado en células primitivas del epitelio folicular. El CCBs es un tumor que crece lentamente y como otros tumores tiene períodos de regresión espontánea. El aumento de mastocitos (Ms) y linfocitos en el CCBs ha sido considerado un signo de respuesta del huésped contra el tumor. Además hay fuertes evidencias que los Ms intervienen en la remodelación del tejido conectivo durante el catagén del folículo piloso (FP). Para determinar la relación entre la presencia de Ms y la regresión del CCBs y del FP estudiamos 107 casos de CCBs con focos de regresión y analizamos la presencia de Ms alrededor del tumor y de los FP en catagén. Se encontró una media de 43,3 Ms en relación al CCBs y 21,6 Ms alrededor de los FP. La presencia de numerosos Ms en el estroma tanto del FP en catagén y CCBs en regresión podría estar indicando que el CCBs crece y regresa de manera similar al FP o al menos que la respuesta inmune parece ser semejante.
Palabras clave: Carcinoma de células basales en regresión, folículo piloso, mastocitos.
SUMMARY
Basal cell carcinoma (BCC) is the most frequent cutaneous tumor that grows slowly and like other tumours can present spontaneous regression. The increase in the number of mast cell (Mc) and lymphocytes in the BCC has been considered a response sign of host immunity against the tumor. On the other hand there is evidence that the Mc take part in the remodeling of connective tissue during catagen of the HF. To determine the relationship between the presence of Mc and the regression of the BCC and HF, 107 cases of BCC with regression were studied and the presence of Mc around the tumor and HF regression analyzed. An average of 43.3 Mc in relation to BCC and 21.6 Mc around the HF was found. The presence of numerous Mc in the stroma both in the HPamuch of the HF in catagén and BCC in regression could be indicating that the BCC grows and regress resembling to HF or at least the immune response seems to be similar.
Key words: Regressive basal cell carcinoma, hair follicle, mast cell.
INTRODUCCIÓN
El carcinoma de células basales (CCBs) es el tumor cutáneo más frecuente y parece estar originado de células primitivas del epitelio folicular (1,2). Estos tumores crecen lentamente, rara vez dan metástasis y está demostrado que tienen períodos de regresión espontánea (1,3). Se ha observado un aumento de linfocitos y mastocitos (Ms) rodeando a los nidos tumorales y esto ha sido considerado como un signo de la respuesta inmunológica del huésped contra el tumor (1,3-6). Por otra parte hay fuertes evidencias que los Ms intervienen en la remodelación del tejido conectivo durante el catagén del folículo piloso (FP) (1,7). El objetivo de nuestro trabajo es determinar la relación entre la presencia de Ms en la regresión del CCBs y del FP.
MATERIALES Y MÉTODOS
Se analizaron en forma retrospectiva 107 casos de CCBs con focos de regresión. Fueron descartados 18 por ser técnicamente inadecuados. La regresión fue calificada cómo activa, inactiva y mixta. La activa evidenciaba infiltrados linfoides rodeando y penetrando los nidos tumorales junto a células apoptóticas (fig. 1). La inactiva fue reconocida por fibrosis peritumoral, neovascularización e infiltrados inflamatorios linfoplasmocitarios (fig. 2). Se calificó como mixta cuando ambos patrones estaban presentes. Se realizó el conteo de mastocitos alrededor del tumor, en 321 FP adyacentes a los nidos tumorales y en la piel sana. El recuento de los Ms fue realizado en 10 CGA alrededor del tumor (fig. 3) y en la periferia de los FP (fig. 4). El material fue coloreado con H&E y giemsa para resaltar los gránulos metacromáticos de los Ms (fig. 5). Se realizó inmunomarcación para Ms con MAST cell tryptase clon AA1, DAKO (fig. 6).
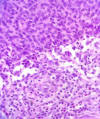
Fig. 1: Regresión activa: infiltrados
linfoides rodeando y penetrando los nidos tumorales (H-E x400).
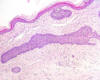
Fig. 2: Regresión inactiva: marcada
fibrosis, neovascularización e infiltrados inflamatorios linfoplasmocitarios
(H-E x100).
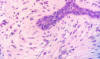
Fig. 3: Presencia de Ms peritumorales (H-E
x100).
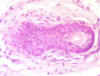
Fig. 4: Ms en la periferia de los FP (H-E
x100).
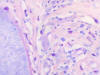
Fig. 5: Gránulos metacrormáticos en los Ms
(Giemsa x400).
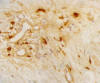
Fig. 6: Inmunomarcación citoplasmática con
MAST cell tryptase clon AA1 DAKO (x400).
RESULTADOS
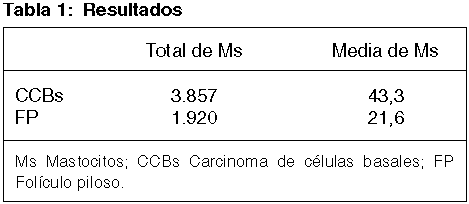
Los resultados se resumen en la tabla 1. De los CCBs 40 mostraron regresión activa, 44 regresión inactiva y 5 un patrón mixto (tabla 2). En 45 CCBs los infiltrados inflamatorios contenían además de los Ms, células plasmáticas y escasos linfocitos alrededor de los FP, pero no dentro de ellos en 25 casos y células apoptóticas con linfocitos infiltrando el istmo y el infundíbulo piloso en los restantes 20 casos. No hallamos diferencia estadísticamente significativa entre la presencia de Ms alrededor del CCBs y del FP.

DISCUSIÓN
Los Ms son células mediadas por inmunoglobulina E derivadas de la médula ósea que contienen numerosos gránulos de histamina, heparina, factores quimiotácticos, ACTH, sustancia P y proteasas (4,7).
La remodelación del tejido conectivo parece estar promovida por los Ms. Cohen y col observaron un incremento de los Ms en varias enfermedades cutáneas con marcada fibrosis como esclerodermia, enfermedad injerto contra huésped y porfiria. También mencionan que los Ms intervienen en el crecimiento del CCBs y que la variante morfeiforme tendría mayor número de Ms y estos estarían relacionados con la producción de colágeno (4,5,8). Recientemente Maurer y col (7) refieren que los Ms son importantes moduladores del crecimiento del epitelio folicular e intervienen en las fases de anagén, catagén y telogén. Observaron que los FP están inmersos en un estroma rico en Ms y hay evidencias que sugieren que el FP sería el blanco de las funciones morfomoduladoras de los Ms. Además informaron que la degranulación de los Ms se incrementa en el catagen. Por esto la regresión del FP podría retardarse inhibiendo la degranulación e induciendo la secreción de ACTH y sustancia P (1,7,9).
Deng y col relatan que los linfocitos T cooperadores y citotóxicos median el crecimiento tumoral y se hallan en mayor porcentaje en los CCBs en regresión. Observaron además un aumento del número de Ms peritumorales postulando que los mismos no sólo tendrían capacidad citotóxica sino que estimularían otras poblaciones inmunes alterando la respuesta linfocitaria. Con la secreción del factor de necrosis tumoral estimularían la proliferación de linfocitos, mientras que con la liberación de histamina inhibirían la blastogénesis linfocitaria (3).
En relación a la histogénesis del CCBs es discutida. Schiren y col postulan que el CCBs, el tricoblastoma y el FP tienen un patrón morfológico e inmunológico de citoqueratinas idénticos sugeriendo una diferenciación común (1,2,10,11).
En nuestro estudio evidenciamos un incremento de Ms en relación al tumor y al FP como ha sido observado por otros autores (1,3-9). También apreciamos un aumento significativamente mayor de Ms en la fase de regresión inactiva donde predomina la fibrosis.
El CCBs y el FP parecen compartir características similares en cuanto a su origen, la función inmunitaria del huésped y el ciclo de crecimiento; nuestros datos podrían estar indicando que el CCBs crece y regresa de manera similar al FP, o al menos la respuesta inmune parece ser semejante.
BIBLIOGRAFÍA
Lespi PJ, Gregorini SD. Folliculotropic T cell in Regressive Basal cell Carcinoma of Skin. Am J Dermatopathol 2000; 22: 30-3.
Schirren CG, Rutten A, Kaudewitz P, Diaz C, McClain S, Burgdorf WH. Trichoblastoma and basal cell carcinoma are neoplasms with follicular differentiation sharing the same profile of cytokeratin intermediate filaments. Am J Dermatopathol 1997; 19: 341-50.
Deng JS, Brod BA, Saito R, Tharp MD. Immune-associated cells in basal cell carcinomas of skin. J Cutan Pathol 1996; 23: 140-3.
Cohen MS, Rogers GS. The significance of mast cell of basal cell carcinoma. J Am Acad Dermatol 1995; 33: 514-7.
Erkilic S, Erbagci Z. The significance of mast cells associated with basal cell carcinoma. J Dermatol 2001; 28: 312-15.
Patel A, Halliday GM, Cooke BE, Barnetson RS. Evidence that regression in keratoacanthoma is immunologically mediated: a comparison with squamous cell carcinoma. Br J Dermatol 1994; 131: 789-98.
Maurer M, Fischer E, Handjiski B, von Stebut E, Algermissen B, Bavandi A, Paus R. Activated skin mast cells are involved in murine hair follicle regression (catagen). Lab Invest 1997; 77: 319-32.
Grimbaldeston MA, Skov L, Baadsgaard O, Skov BG, Marshman G, Finlay-Jones JJ, Hart PH. High dermal mast cell prevalence is a predisposing factor for basal cell carcinoma in humans. J Invest Dermatol 2000; 115: 317-20.
Christoph T, Muller-Rover S, Audring H, Tobin DJ, Hermes B, Cotsarelis G, et al. The human hair follicle immune system: cellular composition and immune privilege. Br J Dermatol 2000; 142: 862-73.
Kurzen H, Esposito L, Langbein L, Hartschuh W. Cytokeratins as markers of follicular differentiation: An immunohistochemical study of trichoblastoma and basal cell carcinoma. Am J Dermatopathol 2001; 23: 501-9.
Kore-eda S, Horiguchi Y, Ueda M, Toda K, Imamura S. Basal cell carcinoma cells resemble follicular matrix cells rather than follicular bulge cells: immunohistochemical and ultrastructural comparative studies. Am J Dermatopathol 1998; 20: 362-9.