
Vol. 36, n.º 1, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 1, 2003 |
Antonio Urban Ramón, Adriá Jovani Meseguer, Olga García Vidal, Isabel Antón Antón1, Concepción Murcia Mesa
Servicios de Anatomía Patológica y de Oncología1 del Hospital Sant Jaume de Calella. C/ Sant Jame 209-217. 08370 Calella, Barcelona.
RESUMEN
Planteamiento: El hemangiopericitoma es un tumor vascular maligno infrecuente de los pericitos de Zimmerman que están rodeando los espacios vasculares. Representa el 0,1% de los tumores malignos óseos y únicamente el 0,08% de los tumores primarios óseos.
Material y método: Nosotros describimos un caso hemangiopericitoma óseo del húmero en una mujer de 69 años, diagnosticado con la ayuda del material citológico obtenido de la punción aspiración con aguja fina, y posteriormente de la biopsia ósea.
Resultados: El material citológico el obtenido del bloque celular fue de gran utilidad, permitió descartar algunos de los procesos neoplásicos óseos primarios y metastásicos más frecuentes de origen desconocido, tal como el pulmonar y el renal. La inmunohistoquímica realizada sobre cortes histológicos nos afianzó el diagnóstico de hemangiopericitoma.
Conclusiones: El diagnóstico diferencial citológico e histológico del hemangiopericitoma óseo se tiene que hacer con los tumores fusocelulares primarios óseos y metastásicos, fundamentalmente con el condrosarcoma mesenquimal, el osteosarcoma de células pequeñas, el histiocitoma fibroso maligno y el sarcoma sinovial; y con las metástasis óseas del leiomiosarcoma y el melanoma. Antes de confirmar un hemangiopericitoma óseo como primario hay que descartar un probable origen metastásico. Los hemangioperictomas primarios óseos tienen un pronóstico incierto, por lo tanto los debemos de considerar biológicamente malignos.
Palabras claves: Hemangiopericitoma, hemangiopericitoma primario óseo, tumor vascular óseo maligno.
SUMMARY
Background: Hemangiopericytoma is a rare malignant vascular tumor of pericyte origin, accounting for 0.1% of all malignant bone tumors and only 0.08% of total primary bone tumors.
Material and Method: We describe a case of intraosseus hemangiopericytoma in the right humerus of a 69 year old female, diagnosed by aspiration cytology and subsequently by bone biopsy.
Results: Cell block preparations were very useful showing some clusters of spindle-shaped cells tumors around vascular spaces. Immunohistochemistry permitted ruling out some of the most common primary bone tumors and metastases most common, such as kidney and lung carcinomas.
Conclusions: Bone hemangiopericitoma should be differentiated from primary bone and metastic spindle cell tumors including: Mesenchymal chondrosarcoma, small cell osteosarcoma, malignant fibrous histyocytoma and synovial sarcoma and from bone metastases from leiomyosarcoma and malignant melanoma. Also, before making the diagnosis of primary bone hemangioperycitoma, hemangiopeycitoma soft tissue with bone metastasis must be ruled out. Hemangiopericytomas of the bone have an uncertain prediction and therefore should be considered biologically malignant.
Key words: Hemangiopericytoma, primary bone hemangiopericytoma, malignant vascular bone tumor.
INTRODUCCIÓN
El hemangiopericitoma es un tumor vascular maligno de los pericitos que rodean los capilares y vénulas postcapilares, exhibiendo un potencial de malignidad variable e incierto. El pico de incidencia se da en la 4.ª-5.ª década de la vida. Representa el 2,5% de las neoplasias de partes blandas, el 0,1% de los tumores malignos óseos y solo el 0,08% de los tumores primarios óseos (1-4). La mayoría se localizan en la pelvis y extremidades inferiores (4). Clínicamente, la fractura ósea patológica es una de las formas de presentación del hemangiopericitoma óseo, al igual que la aparición de dolor por compresión de las estructuras adyacentes (2).
Nosotros describimos un caso de hemangiopericitoma primario óseo, de localización humeral, descubierto a raíz de una fractura patológica. El diagnóstico se estableció con el material obtenido de la punción aspiración con aguja fina de la lesión tumoral osteolítica y con la biopsia ósea, realizando su posterior discusión.
CASO CLÍNICO
Mujer de 69 años de edad, diabética e hipertensa, sin otros antecedentes patológicos de interés. Ingresó en nuestro centro por sintomatología de dolor del lado derecho de la espalda y a la movilización de la extremidad superior derecha, de dos meses de evolución. La radiografía ósea del hombro derecho mostró una fractura patológica del tercio superior del húmero, por una lesión osteolítica tumoral de aproximadamente 6 cm de diámetro mayor, parcialmente bien circunscrita y encapsulada, y con expansión hacia las partes blandas circundantes (fig. 1). Asimismo, la radiografía de tórax evidenció metástasis pulmonar en «suelta de globos» y la gammagrafía ósea una hipercaptación del tercio superior del húmero derecho y pequeños focos de captación en la columna lumbar (L3, L4 y L5). Se procedió a la punción aspiración con aguja fina y, a continuación, a la biopsia «tru-cut» de la lesión osteolítica tumoral del húmero derecho. No se realizó ningún tratamiento quirúrgico de resección, tan sólo se aplicó radioterapia inicial para disminuir el dolor y la masa tumoral ósea, y posteriormente tratamiento quimioterápico. La respuesta de la paciente a la terapéutica oncológica no resultó eficaz, falleciendo a los nueve meses del diagnóstico tumoral.
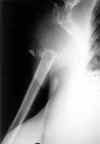
Fig. 1. Rx
ósea del húmero derecho. Fractura ósea patológica.
MATERIAL Y MÉTODOS
Se obtuvieron 10 c.c. de material serohemático. Unas extensiones citológicas fueron fijadas en alcohol y otras secadas al aire, y teñidas respectivamente con Papanicolaou y Giemsa. Se realizó la elaboración del bloque celular con el método plasma-trombina.
El material obtenido en el bloque celular, al igual que los escasos fragmentos de tumor procedentes de la biopsia ósea: blandos y marronaceos que agrupados medían 0,8 ¥ 0,5 ¥ 0,2 cm, se fijaron con la solución de formaldehído al 10% e incluyeron de forma habitual en parafina. Secciones de 4 micras de grosor fueron teñidas con hematoxilina-eosina y otras secciones desparafinadas teñidas con la técnica de inmunohistoquímica, utilizando el método avidina-biotina-peroxidasa y empleando los anticuerpos comerciales (Dako) para el factor VIII, CD-34, HMB-45, vimentina, proteína S-100, desmina, actina y el anticuerpo comercial (Becton Dickinson) para la citoqueratina CAM 5.2.
HALLAZGOS MICROSCÓPICOS
Las extensiones citológicas marcadamente serohemáticas mostraron ocasionales células atípicas aisladas, de núcleos grandes con una cromática grumosa y de bordes citoplasmáticos imprecisos. Sin embargo, el material obtenido en el bloque celular fue de mayor utilidad, visualizándose tres pequeñas placas tumorales de células fusiformes, de núcleos grandes y ovoides con una cromatina grumosa y de citoplasmas eosinófilos, sin evidenciar figuras de mitosis. Entre las células neoplásicas se apreciaban espacios o lagunas de apariencia vascular (fig. 2).

Fig. 2. Bloque celular. Placa tumoral de
células fusiformes.
Las características histológicas de la biopsia fueron semejantes a las observadas en el bloque celular, aunque con una mayor precisión de los espacios vasculares, algunos esbozando formas en «asta de ciervo», rodeados de las células neoplásicas que manifestaban una moderada atipia nuclear con ocasionales figuras de mitosis, y sin observar áreas de necrosis tumoral (fig. 3). El estudio inmunohistoquímico mostró positividad de las células tumorales para la vimentina, y el endotelio de los espacios vasculares para el antígeno relacionado con el factor VIII y el CD-34 (fig. 4), y negatividad para el resto de los marcadores empleados (proteína S-100, citoqueratina CAM 5.2, desmina, actina y HMB-45).

Fig. 3. Biopsia ósea. Proliferación de
células fusiformes neoplásicas rodeando espacios vasculares, algunos en forma
de "asta de ciervo" (x100).
Fig. 4. Inmunohistoquímica:
espacios vasculares expresando el antígeno CD34 (x400).
DISCUSIÓN
El hemangiopericitoma es un tumor infrecuente, principalmente de localización en partes blandas de las extremidades inferiores, fosa pélvica y retroperitoneo, y más inusual como tumor óseo. Se trata de un tumor vascular de los pericitos de Zimmerman que rodean a los espacios vasculares (5). Histológicamente, se dividen en benignos, intermedios (borderline) y malignos, en función de la celularidad, atipia nuclear y actividad mitótica (3,4). Las primeras metástasis de los hemangiopericitomas aparecen de forma temprana o tardía, incluso bastantes años después del diagnóstico, principalmente pulmonares y óseas (3).
En el presente caso, el material citológico fue de gran utilidad en la orientación y en el diagnóstico del tumor óseo, fundamentalmente con el material obtenido del bloque celular. De hecho, cuando el material citológico de una punción aspiración de una lesión ósea es idóneo, unido a una buena información clínica y de radiodiagnóstico, permite discernir de forma substancial entre lesiones óseas benignas y malignas, primarias y metastásicas, y linfomas y mielomas (6-8). Del mismo modo, que el bloque celular proporciona la posibilidad de efectuar un estudio inmunohistoquímico más completo, permitiendo descifrar el fenotipo de gran parte de los tumores malignos indiferenciados (9-12).
El diagnóstico diferencial se realizó con la mayoría de los tumores óseos primarios y metastásicos con un patrón fusocelular, especialmente con el condrosarcoma mesenquimal y desdiferenciado, el osteosarcoma de células pequeñas, el histiocitoma fibroso maligno, el sarcoma sinovial y con las metástasis óseas del leiomiosarcoma y el melanoma.
Citológicamente, el fondo condromixoide o matriz condroide metacromática (tinción de Giemsa) presente en el condrosarcoma mesenquimal, aunque sea escaso, resulta esencial para el diagnóstico diferencial con el hemangiopericitoma. (13,14).
El condrosarcoma desdiferenciado, tumor compuesto por un condrosarcoma bien diferenciado con áreas de sarcoma no-condroide de alto grado, como el histiocitoma fibroso maligno que, además, puede ostentar un patrón vascular similar al del hemangiopericitoma, presenta en estas áreas no-condroides células tumorales con un grado de atipia mucho más acusada que las células del hemangiopericitoma y simultáneamente se acompañan de las típicas células gigantes anaplásicas de tipo histiocitario del histiocitoma fibroso maligno (2).
La citología del osteosarcoma se fundamenta en la observación de las células tumorales de apariencia osteoblástica junto al material de fondo con semejanza al osteoide (15,16). Puede suceder que en el osteosarcoma de células pequeñas haya una mayor dificultad en la visualización del material osteoide, sin embargo las células osteoblásticas manifiestan unos núcleos más pequeños y homogéneos que los del hemangiopericitoma.
El sarcoma sinovial es un tumor bifásico de partes blandas y más raramente intra-articular con un patrón fusocelular prominente, pero a diferencia de los hemangiopericitomas, los núcleos son más fusiformes e hipercromáticos. Es indispensable en el diagnóstico citológico del sarcoma sinovial la búsqueda en las extensiones citológicas de los elementos glandulares, en ocasiones con la ayuda de la inmunotinción (12,17,18). En los casos de mayor duda diagnóstica o en los sarcomas sinoviales de proliferación monofásica, puede resultar de gran utilidad la detección de la translocación entre los cromosomas X y 18: t(X;18) (p11.2; q11.2) en las células neoplásicas del sarcoma sinovial. (19).
La inmunotinción en los cortes histológicos evidenció que el tumor óseo de patrón fusocelular era de estirpe mesenquimal (vimentina positiva), rodeando el endotelio de los espacios vasculares. La negatividad para la proteína S-100 y el HMB-45 descartaron el melanoma maligno metastásico, y la falta de expresión para desmina y actina, el leiomiosarcoma metastásico.
Antes de establecer el diagnóstico de hemangiopericitoma primario intraóseo hay que descartar su probable origen metastásico. En el caso patológico que nos ocupa no se describía ningún antecedente neoplásico. Tampoco, se visualizaron en las exploraciones de radiodiagnóstico otras masas extraóseas concomitantes, a excepción de la diseminación pulmonar y de los focos de captación ósea gammagráfica lumbar, atribuibles a pequeños focos de metástasis óseas.
El pronóstico de los hemangiopericitomas se correlaciona con el grado histológico. No obstante, los hemangiopericitomas primarios de localización ósea por su alto potencial de recidiva y de metástasis, incluso bastantes años después de su diagnóstico, con independencia del grado histológico, se deben de considerar de comportamiento biológico maligno (3,4).
El tumor óseo que presentamos debió de tener un crecimiento intraóseo progresivo silente durante un largo periodo de tiempo, antes de su expansión hacia los tejidos blandos adyacentes, con resultado de fractura ósea patológica, manifestándose clínicamente y de forma simultánea con las metástasis.
El tratamiento de elección de los hemangiopericitomas óseos se basa en la resección quirúrgica radical con radioterapia posterior, dejando solo la quimioterapia para los casos diseminados (2,20,21).
AGRADECIMIENTOS
Agradecemos a las citotécnicas de laboratorio Celia Orrit Brossa y Griselda Estrague por su colaboración en las técnicas de inmunotinción y en la preparación del bloque celular, así como en la trascripción del manuscrito.
BIBLIOGRAFÍA
Birzgalis AR, Ramsden RT, Lye RH, Richardson PL. Haemangiopericytoma of the temporal bone. J Laryngol Otol. 1990; 104: 998-1003.
Chhieng D, Cohen JM, Waisman J, et al. Fine-neelde aspiration cytology of hemangiopericytoma: A report of five cases. Cancer. 1999; 87: 190-5.
Tang JS, Gold RH, Mirra JM, Eckardt J. Hemangioperycitoma of bone. Cancer. 1988; 62: 848-59.
Wold LE, Unni KK, Cooper KL et al. Hemangiopericytoma of bone. Am J Surg Pathol. 1982; 6: 53-8.
Stout A.P., Murray M.R. Hemangiopericytomas: vascular tumor featuring Zimmermann’s pericytes. Ann Surg. 1942; 116: 26-33.
Kreicbers A, Bauer HCF, Brosjö O, et al. Cytological diagnosis of bone tumours. J Bone Joint Surg.1996; 78-B: 258-63.
Rougraff BT, Kneisl JS, Simon MA. Skeletal metastases of unknown origin: a prospective study of a diagnostic strategy. J Bone Joint Surg 1993; 75-A: 1276-81.
Kindblom L.G. Light and electron microscopic examination of embedded fine-needle aspiration biopsy specimens in the preoperative diagnosis of soft tissue and bone tumors. Cancer, 1983; 51: 2264-77.
Hanson C.A. Fine-needle aspiration and immunophenotyping: a role in diagnostic histopathology. Am J Clin Pathol 1994; 101: 55-6.
Burt A, Smillie D, Cowan MD, Adams FG: Fine needle aspiration cytology: experience with a cell block technique. J Clin Pathol 1986; 39: 114-5.
Kung ITM, Chan S, Lo ESF. Application of the immunoperoxidase technique to cell block preparations from fine needle aspirates. Acta Cytol 1990; 34: 297-303.
Wedin R, Bauer HCF, Skoog L, et al. Cytological diagnosis of skeletal lesions: fine-needle aspiration biopsy in 110 tumours. J Bone Joint Surg. 2000; 82-B(5): 673-78.
Doria MIJr, Wang HH, Chinoy MJ. Retroperitoneal mesenchymal chondrosarcoma. Report of a case diagnosed by fine needle aspiration cytology. Acta Cytol 1990; 34: 529-32.
González-Campora R, Otal-Salaverri C, Hevia-Vazquez A. et al. Fine needle aspiration in myxoid tumors of the soft tissues. Acta Cytol. 1990; 34: 179-192.
Walaas L, Kindblom L.G. Light and electron microscopic examination of fine-needle aspirates in the preoperative diagnosis of osteogenic tumors: a study of 21 osteosarcomas and two osteoblastomas. Diagn Cytopathol. 1990; 6: 27-38.
White VA, Fanning CV, Ayala AG, Raymond AK et al. Osteosarcoma and the role fine-needle aspiration. A study of 51 cases. Cancer. 1988; 62: 1238-46
Akerman M, Willen H, Carlen B, et al. Fine needle aspiration (FNA) of synovial sarcoma: a comparative histological-cytological study of 15 cases, including immunohistochemical, electron microscopic and cytogenetic examination and DNA-ploidy analysis. Cytopathology. 1996; 7: 187-200.
Silverman JF, Landreneau RJ, Sturgis CD, et al. Small-cell variant of synovial sarcoma: fine-needle aspiration with ancillary features and potential diagnostic pitfalls. Diagn Cytopathol . 2000; 23: 118-23.
Nisson G, Wang M, Wejde J, et al. Reverse transcriptase polymerase chain reaction on fine needle aspirates for rapid detection of translocations in synovial sarcoma. Acta Cytol. 1998; 42: 1325-6.
Beadle G.F., Hillcoat B.L. Treatment of advanced malignant hemangiopericytoma with combination adrimycin and DTIC: a report of four cases. J Surg Oncol. 1983; 22: 167-70.
Mira J.G., Ch F.C.H., Fortner J.G. The role of radiotherapy in the management of malignant hemangiopericytoma. Cancer. 1977; 39: 1254-9.