
Vol. 35, n.º 3, 2002
REVISTA
ESPAÑOLA DE
Vol. 35, n.º 3, 2002 |
Margarita Gimeno, César Lacruz, José Ignacio Salmerón1, Julio Acero1
Servicio de Anatomía Patológica y 1Servicio de Cirugía Maxilofacial. 91 586 85 68. Hospital General Universitario Gregorio Marañón. Madrid.
RESUMEN
Los virus del papiloma humano son virus DNA epiteliotropicos implicados en carcinogénesis cervical , evaluándose en la actualidad su papel en carcinogénesis oral. El aumento de la incidencia de cáncer epidermoide de cérvix uterino en pacientes con SIDA plantea la posible interacción HPV - HIV en su desarrollo y, por extensión, en el de carcinoma epidermoide de otras localizaciones extragenitales. Presentamos un caso de carcinoma escamoso de paladar en paciente joven con síndrome de inmunodeficiencia adquirida, en el que se demuestra la presencia de HPV en las células neoplásicas mediante hibridación in situ utilizando una sonda genérica. Posteriormente , con técnica de PCR, se detectó HPV-18 (de alto riesgo oncogénico). Pensamos que la posible interacción oncogénica HPV-HIV puede darse en otras localizaciones aparte de la genital.
Palabras clave: Carcinoma epidermoide oral; papilomavirus, DNA viral, Infección HIV. P.C.R.
SUMMARY
HPV are DNA epitheliotropic virus involved in cervical cancer; their implications in oral cancer are presently under study. The increase in the incidence of cervical cancer in patients with AIDS suggests a potential interaction between HPV-HIV in the development of this carcinoma and in the carcinomas at other extragenital sites. We present a case of squamous carcinoma of the palate in a young patient with AIDS, in which positive internuclear staining for HPV DNA was found in some neoplasic cells when using an in-situ hibridation method. PCR technique permitted detection of HPV-type 18 (high oncogenic risk), adding support to a possible oncogenic interaction between HPV-HIV at other extragenital locations.
Key words: Squamous cell carcinoma, oral; Papillomavirus; DNA viral; HIV Infections, Polymerase Chain reaction.
INTRODUCCIÓN
El carcinoma de células escamosas es una neoplasia que ocurre raramente en paladar, y aparece más frecuentemente en varones entre la 6.ª y 8.ª década de la vida, su etiología es variable, estando generalmente relacionado con carcinógenos tipo tabaco y alcohol (1,2).
Actualmente y como resultado de estudios epidemiológicos y biológicos se ha conocido la conexión entre infección por virus del papiloma humano y lesiones escamosas de cavidad oral y tracto respiratorio superior (3,4), mientras que otros estudios llegan a demostrar la presencia de virus del papiloma humano en aproximadamente el 50% de los carcinomas de células escamosas e hiperplasias orales, fundamentalmente los denominados tipos de alto riesgo (HPV-16 y HPV-18) (5,6).
Por otra parte, mientras que en mujeres con síndrome de inmunodeficiencia adquirida (SIDA) se ha evidenciado un aumento de incidencia de neoplasia cervical uterina, en pacientes también con SIDA no hay evidencia demostrada de un aumento en la suceptibilidad al desarrollo de cancer oral (7,8).
Presentamos un caso de paciente HIV (+) asintomático, en estado de portador para virus de la hepatitis B, C y D, que desarrolla, en paladar, un carcinoma de células escamosas, en el que se detecta HPV-18 mediante hibridación in situ y amplificación genómica (P.C.R.)
CASO CLÍNICO
Paciente varón de 36 años VIH positivo en tratamiento, ex ADVP, con seropositividad para virus de hepatitis B,C y D, trombopenia, bronquitis crónica desde hace 10 años,y actualmente sin carga viral detectable.
Desde hace 2 meses presenta gran tumoración palatina, con dolor y crecimiento progresivo. A la exploración presenta una gran tumoración vegetante e indurada en hemimaxilar derecho, que se extiende desde el área canina a región molar con movilidad de piezas dentarias adyacentes.
En la TAC (fig. 1) se evidencia una lesión expansiva que destruye el reborde alveolar derecho e infiltra partes blandas, deformando el tejido celular subcutáneo. Posteriormente la lesión alcanza la zona anteroinferior de la fosa nasal derecha y del seno maxilar de dicho lado.

Fig. 1. TAC:
Lesión expansiva del paladar que destruye reborde alveolar, alcanza fosa nasal
y seno maxilar.
Se realiza biopsia de la lesión recibiéndose fijados en formol al 10% dos fragmentos irregulares de 8 ¥ 4 mm.
Histológicamente corresponden a fragmentos de mucosa escamosa procedente de paladar, en los que se identifica una neoplasia epitelial maligna constituida por nidos y cordones sólidos de células epiteliales escamosas con atipias nucleares,citoplasma eosinófilo y moderada actividad mitótica. Algunas células neoplásicas muestran halos claros perinucleares (fig. 2). El tumor infiltra el estroma con marcada respuesta desmoplásica y reacción inflamatoria crónica .

Fig. 2. Carcinoma
epidermoide bien diferenciado con halos claros perinucleares. HE x100.
Posteriormente se indica cirugía mediante maxilectomía parcial derecha y posterior reconstrucción con colgajo temporal ipsilateral, recibiendose una pieza de hemimaxilectomía derecha de 7 ¥ 6 cms, que incluye un total de 6 piezas dentarias (tres dientes, un canino, y dos molares) y que presenta en región premolar y extendiendose hasta el segundo diente un área blanquecina irregular excrecente de 2 cms, que al corte está formada por una masa blanca de aspecto uniforme de 2,5 cms.
En el área retromolar existe una zona ulcerada de aproximadamente 1 cm, siendo la encía de aspecto rugoso y blanquecino.
Histológicamente, corresponde a una neoplasia de similares características a las observadas en la biopsia previa, tipo carcinoma epidermoide queratinizante bien diferenciado, con lesiones de tipo carcinoma intraepidérmico en la mucosa. La neoplasia infiltra en profundidad, respetando márgenes quirúrgicos y hueso (fig. 3).

Fig. 3. Área
de infiltración de carcinoma epidermoide bien diferenciado. HE x100.
Tanto en la biopsia previa como en las muestras escogidas de la pieza quirúrgica,se detecta ADN de HPV por hibridación in situ utilizando una sonda genérica (PATHOGEN-ENZO).La positividad se observa fundamentalmente en las células queratinizantes de la superficie del tumor (fig. 4). Posteriormente , mediante reacción en cadena de la polimerasa (PCR) (Kit Master Diagnóstica), se comprueba que este es del tipo 18 (alto riesgo oncogénico).
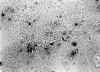
Fig. 4. Hibridación
in situ. Positividad de células neoplásicas para DNA de HPV.
DISCUSIÓN
El carcinoma de células escamosas es el tumor maligno más común de la mucosa de la cavidad oral. El 77% de los carcinomas orales se desarrollan entre los 55 y 77 años, siendo las localizaciones más frecuentes el suelo de la boca, cara lateral y ventral de la lengua y surcos alveolares mandibulares. En contraste, el paladar es una localización infrecuente (1).
Los factores etiológicos más directamente relacionados con estas localizaciones son los más conocidos, tales como tabaco, alcohol, infecciones (sífilis, candidiasis), y enfermedades mucocutáneas (liquen plano) (1). Por otra parte, estudios epidemiológicos y biológicos recientes han relacionado al virus del papiloma humano, conocido responsable del cancer de cérvix uterino y del tracto anogenital (7,9,10,11), con algunos cánceres de cabeza y cuello, en concreto de cavidad oral (59%), faringe (43%), y laringe (33%) (5,6,12-14), estando claramente reconocido también su papel etiológico en lesiones de cavidad oral benignas (Papiloma escamoso, hiperplasia epitelial focal , condiloma acuminado, y verruga vulgar) y premalignas (displasia epitelial oral). (3,4,15). En la mayoría de los tumores positivos para HPV de estas localizaciones los virus son de alto riesgo, tipo 16 (entre 22 y 40%) y 18 (entre 11,9 y 14%) (12,13,16).
También se ha detectado ADN del virus del papiloma humano en mucosa oral normal, en concreto el subtipo 16 en un 10% y el subtipo 18 en un 11% de los casos. Se desconoce el significado de este hallazgo, pudiendo pensarse que el virus no ha producido todavía lesión, o que en muchos casos las lesiones pueden regresar espontanarmente (13). No obstante, la proporción es muy inferior a la demostrada en los carcinomas.
Sugerman (13) sugiere que la infección por HPV de alto riesgo puede ser un co-factor en carcinogénesis oral y que la infección latente por el virus es común. La presencia del virus del papiloma humano no sería suficiente para ocasionar la transgresión maligna, siendo necesarios, probablemente, cambios genéticos adicionales para la progresión a un estadio neoplásico El papel de la infección por HPV en la carcinogénesis oral se plantea por la posibilidad de inmortalización de los queratinocitos infectados por HPV (13).
Es conocido que las oncoproteínas E6 y E7 elaboradas por el ADN viral bloquean las proteínas p53 y Rb, dejando sin control el ciclo celular e inmortalizando las células afectadas. Las lesiones hiperproliferativas, así originadas, tienen un riesgo mucho mayor para la adquisición de errores genéticos adicionales, quizás bajo la influencia de agentes mutágenos externos, lo que finalmente induce al desarrollo de un fenotipo celular plenamente maligno (12).
Otros estudios de tumores de cabeza y cuello han identificado alteración de varios genes que regulan el control del ciclo celular incluyendo genes supresores tumorales de p53 y p16 y la ciclina D1 (oncogen PRAD 1) . Datos actuales muestran mutación de p53 en 42% de tumores de cabeza y cuello, la p16 está alterada en 67% de los tumores y la ciclina D1 está amplificada en 30% de los tumores (12).
La patogénesis de los tumores orales también se ha relacionado con infección viral persistente HHV8 y HPV con interacciones moleculares con el HIV, que contribuirían a las alteraciones genéticas que desencadenarían el desarrollo de tumor participando como cofactores en el desarrollo del carcinoma epidermoide oral por activación, amplificación y sobre expresión de oncogenes preexistentes dentro de los tejidos neoplásicos (7,17).
Por lo que respecta a la interacción HPV-HIV, es conocido el aumento de la incidencia del cancer de cérvix uterino en mujeres HIV (+); asimismo el ADN-HPV es mas frecuentemente detectado en mujeres infectadas por HIV que en mujeres seronegativas, teniendo las mujeres infectadas un riesgo más elevado de desarrollo de lesiones escamosas intraepiteliales que en las no infectadas. En estas pacientes con infección por HIV, la inmunodeficiencia jugaría un papel importante en el desarrollo del tumor, con un efecto más severo del HPV sobre el epitelio escamoso (18).
Leigh (19) propone que el papel del HPV en el desarrollo de lesiones cutáneas y orales en estos pacientes, sería debido a la inmunosupresión , de forma similar a lo que ocurre en pacientes inmunosuprimidos por transplantes de órganos, en los que existe un alto riesgo de desarrollo de neoplasias malignas epiteliales.
El caso que presentamos muestra la peculiaridad de ser un paciente joven HIV (+), con un carcinoma epidermoide oral ,ampliamente invasivo, de localización infrecuente( paladar), en el que se demuestra una intensa expresión viral del virus del papiloma humano (HPV) en las células tumorales. Considerando que para resultar positiva la técnica de hibridación in situ son necesarias más de 20 copias virales por célula (20), pensamos que la coexistencia de la infección por HIV ha permitido esta gran expresión viral, siendo un factor determinante en el desarrollo y progresión de la lesión.
BIBLIOGRAFÍA
Cawson RA, Binnie W, Speight P, Barrett AW, Wright JM. Luca’s Pathology of tumors of the oral tissues. «Tumors os the oral epithelium». Fifth edition 1998 Churchill Livingstone. London.
Koch WM, Lango M, Sewell D, Zahurak M, Sidransky D: Head and neck cancer in nonsmokers: a distinct clinical and molecular entity. Laryngoscope 1999, 109 (10): 1544-51.
Badaracco G, venuti A, Morello R, Muller A, Marcante ML. Human papillomavirus in head and neck carcinomas: prevalence, phisical y with clinical/pathological parameters. Anticancer Res 2000, 20 (2B): 1301-5.
Elamin F, Steingrimsdottir H, Wanakulasuriya S, Johson N, Tavassoli M. Prevalence of human papillomavirus infection in premalignant and malignant lesions of the oral cavity in U.K. subjects: a novel method of detection. Oral Oncol 1998 34, 3: 191-7.
Niv A, Sion-Vardi N, Gatot A, Nash M, Fliss DM. identification and typing of human papillomavirus (HPV) in squamous cell carcinoma in oral cavity and oropharynx. J Laryngol otol 2000, 114 (1): 41-6.
Aggelopoulou EP, Skarlos D, Papadimitriou C, Kittas C, Troungos C. Human papilloma virus DNA detection in oral lesions in the Greek population. Anticancer Res 1999, 19: 2B, 1391-5.
Romito A, Grizzuti MA, Tucci M, Sivestris F. Malignant neoplasms and AIDS. Review of the literature and critical considerations on a case of epidermoid carcinoma of the anus. Recenti Prog Med. 1997 88: 348-55.
Brockmeyer N, Barthel B. Clinical manifestations and therapies of AIDS associated tumors. Eur J Med Res 1998, 3: 127-47.
Crum CP. Contemporary theories of cervical carcinogenesis: the virus, the host and the stem cell. Mod Pathol 2000; 13, 3: 243-251.
La Ruche G, Leroy V, Mensah Ado I, Ramon R. Short-term follow up of cervical squamous intraepithelial leisons associated with and human papillomavirus infections in Africa. Int J STD AIDS 1999 10: 363-8.
Unger Er, Vernon SD, Lee DR, Miller DL, Sharma S, Clancy KA, Hart CE, Reves WC. Human papillomavirus type in anal epitehelial lesions is influenced by human immmunodeficiency virus.
McKaig RG, Baric RS, Olshan AF. Human papillomavirus and head and neck cancer: epidemiology and molecular biology. Head Neck 1998, 20: 3, 250-65.
Sugerman PB, Shillitoe EJ. The high risk human papillomaviruses and oral cancer: evidence for and against a causal relationship. Oral Dis. 1997 3: 130-47.
Alvarez Alvarez I, Sanchez Lazo P, Ramos Gonzalez S, Rodrigo Tapia JP, Nuñez Batalla F, Suarez Nieto C. Using polymerase chain reaction to human papillomavirus in oral and pharyngolaryngeal carcinomas. Am J Otolaryngol 1997, 18: 6, 375-81.
Wen S, Tsuji T, Li X, Mizugaki Y, Hayatsu Y, Shinozaki F. Detection and analysis of human papillomavirus 16 and 18 homologous DNA saquences in oral lesions. Anticancer Res 1997 17: 1.ª, 307-11.
Mineta H, Ogino T, Amano HM, Ohkawa Y, Araki K, Takebayashi S, Miura K. Human papilloma virus (HPV) type 16 and 18 detected in head and neck squamous cell carcinoma. Anticancer Res 1998, 18: 6B, 4765-8
Flaitz CM, Hicks MJ. Molecular piracy: the viral link to carcinogenesis. Oral Oncol 1998 34 (6): 448-53.
Rezza G, Giuliani M, Branca M, Benedetto A, Migliore G, Garbuglia AR y col. Determinants of squamous intraepithelial lesions (SIL) on Pap smear: the role of HPV infection and of HIV-1- induced immunosuppression. DIANAIDS Collavorative study group. Eur J Epidemiol 1997, 13: 937-43.
Leight Im, Buchanan JA, Harwood CA, Cerior R, Storey A. Role of human papillomaviruses in cutaneous and oral manifestations of immunosuppression. J Acquir Immune Defic Syndr, 1999,21 Suppl 1: S49-57.
Nuovo GJ. Applications of PCR in situ hybridizattion Human Papillomavirus. In» PCR in situ Hybridization» Raven Press Ch.7. pg 185-220. New York 1992.