
Vol. 35, n.º 3, 2002
REVISTA
ESPAÑOLA DE
Vol. 35, n.º 3, 2002 |
Inmaculada Sánchez-Vegazo Sánchez, Carlos Teruel, Josefina Menéndez
Departamento de Anatomía Patológica de la Clínica Puerta de Hierro. Madrid.
INTRODUCCIÓN
El Lupus Eritematoso Sistémico (LES) es un ejemplo de enfermedad producida por una alteración de los mecanismos de tolerancia inmunológica. La lesión inicial consiste en la aparición de linfocitos B periféricos autorreactivos que escapan a los habituales procesos de regulación. Estos linfocitos B dan lugar a la aparición de una enfermedad autoinmune mediante la producción de autoanticuerpos y también a través de la activación de linfocitos T igualmente autorreactivos (1).
El riñón es uno de los órganos implicados con más frecuencia en el LES. La mayoría de los enfermos con LES presentarán afectación renal en algún momento de su evolución. La lesión renal en el LES es debida tanto al proceso inflamatorio desencadenado por los mecanismos autoinmunes, como a la respuesta de los diversos componentes del tejido renal a dicha inflamación.
Es característica de la nefritis lúpica (NL) la existencia de depósitos inmunes y de infiltrados celulares. Los depósitos inmunes pueden localizarse en el glomérulo, en los vasos y a lo largo de la membrana basal tubular. Los depósitos inmunes pueden ser debidos a la interacción de autoanticuerpos con antígenos renales o al atra pamiento renal de autoantígenos como inmu noglobulinas o nucleosomas sobre los que posteriormente se enlazan los autoanticuerpos. La falta de correlación entre el nivel de autoanticuerpos circulantes y la aparición o no de la enfermedad así como de su gravedad, indica que no todos los autoanticuerpos detectados en el LES son «nefritogénicos» y que la aparición de depósitos inmunes dentro del riñón depende de otros factores además de la tasa de autoanticuerpos circulantes. Los infiltrados celulares renales son debidos principalmente a linfocitos T y su localización es fundamentalmente intersticial.
En respuesta a los depósitos inmunes y a la infiltración por linfocitos T, las células renales endógenas reaccionan con procesos de proliferación y de producción de citoquinas y quimokinas que contribuyen tanto a los procesos de inflamación como a la posterior aparición de fibrosis. La coexistencia por una parte de lesiones renales agudas correspondientes a fenómenos de inflamación y proliferación celular y por otra de lesiones crónicas de fibrosis, caracterizan de forma decisiva las manifestaciones clínicas de la NL, la respuesta al tratamiento y la posible evolución hacia la insuficiencia renal irreversible.
LESIONES HISTOLÓGICAS
La afectación renal del LES se caracteriza por su gran variabilidad morfológica. Casi todas las formas de glomerulonefritis se pueden encontrar en el LES. La naturaleza y la distribución de estas lesiones varían de glomérulo a glomérulo dentro de la misma biopsia e incluso puede ser polimorfa dentro de un mismo glomérulo. Con gran frecuencia hay afectación tubulointersticial y vascular. Lesiones agudas inflamatorias pueden coexistir con lesiones crónicas cicatriciales. Todo ello hace que la interpretación de la biopsia renal sea en ocasiones muy complicada y que hayan sido múltiples los intentos de clasificaciones anatomo-patológicas de esta enfermedad.
La clasificación de la NL más universalmente aceptada es la de la OMS. Fue formulada inicialmente en 1974 (tabla I) y modificada posteriormente en 1982 y 1995 (tabla II) (2,3). Es una clasificación simple y fácilmente reproducible. Proporciona una idea de la severidad y del pronóstico de la afectación renal, y ayuda a seleccionar el tratamiento más adecuado. Con el tiempo se comprobó que para un mismo tipo de NL, la evolución puede ser muy diferente porque hay aspectos de la patología renal que no están incluidos y que han demostrado tener importancia pronóstica. La clasificación de la OMS no individualiza las lesiones inflamatorias agudas y potencialmente reversibles con el tratamiento, de las lesiones cicatriciales no susceptibles de ser tratadas, no realiza una cuantificación de dichas lesiones y no incluye la patología tubulointersticial ni vascular (4).


En un intento de paliar algunas de estas deficiencias se han desarrollado métodos semicuantitativos para analizar las lesiones renales a las que se les atribuye una mayor relevancia clínica y se ha intentado diferenciar las lesiones activas potencialmente reversibles de las inactivas correspondientes a cicatrices irreversibles. El método más aceptado es el descrito por Austin et al (tabla III) (5,6) que consta de un índice de actividad y un índice de cronicidad. Los índices de Austin han sido objeto de controversia. Se ha señalado que presentan una alta variabilidad interobservador y que es difícil establecer una correlación entre la evolución de la nefritis y un determinado valor del índice de actividad o del índice de cronicidad (7). A pesar de estas críticas los índices de Austin han representado un avance importante en el intento de cuantificar las lesiones de la nefritis lúpica y ha supuesto una gran ayuda para el médico clínico. En general, un índice de actividad alto suele asociarse con la necesidad de intensificar el tratamiento inmunosupresor, y un índice de cronicidad elevado con una mala evolución irreversible, sin posibilidad de respuesta al tratamiento (8).

Para mejorar el valor predictivo de la biopsia renal, Hill et al (9) proponen un análisis más detallado que incluye la consideración de cuatro índices histológicos: índice de actividad glomerular, índice de actividad tubulointersticial, índice de cronicidad y un índice de inmunofluorescencia (tabla IV). Según los autores estos nuevos índices guardan una mejor correlación con los parámetros clínicos en el momento de la biopsia y con la evolución de la nefritis que los índices previos. Es preciso disponer de una experiencia más amplia para valorar la importancia real de esta nueva clasificación (10).

Desde nuestro punto de vista creemos que la biopsia renal en el LES ha de ser valorada por el patólogo de forma individualizada y acogerse a la clasificación de la OMS en todos los casos en que esto sea posible, sumando los hallazgos de microscopia óptica con los de inmunofluorescencia y los ultraestructurales. Además, un buen informe patológico debe recoger los grados de actividad y cronicidad así como las lesiones tubulointersticiales y vasculares ya que han de ser tenidos en cuenta por el clínico para decidir el tratamiento, aunque posiblemente su valor sea menos importante para predecir la evolución del proceso en cada paciente.
Describimos a continuación las diversas lesiones que se pueden observar en la nefritis lúpica.
Microscopia óptica (11,12) (figs. 1-5)
Enfermedad mesangial (Tipo II de la OMS)
Las alteraciones morfológicas están limitadas al mesangio.
En el tipo IIa el mesangio es normocelular y solo se detectan alteraciones en el estudio por inmunofluorescencia y/o con microscopia electrónica: hay depósitos confinados exclusivamente al mesangio.
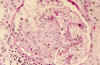
Fig. 1. Lesión
segmentaria con acúmulo de núcleos, necrosis con cariorresis. Sinequia entre
el lóbulo afectado y la cápsula de Bowman.
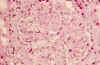
Fig. 2. Lesión
proliferativa, difusa, con morfología de glomerulonefritis membrano
proliferativa.
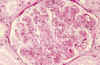
Fig. 3. Trombos
hialinos en luces capilares y frecuente engrosamientos de las MB, con imágenes
en "asa de alambre" (PAS).
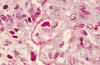
Fig. 4. Depósitos
fuchinófilos subendoteliales (Masson).
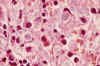
Fig. 5. Abundantes
cuerpos hematoxinófilos, en un ganglio linfático.
En el tipo IIb, además de los depósitos, hay hipercelularidad mesangial, generalmente leve o moderada y ensanchamiento de la matriz mesangial, sin que se altere la luz capilar. Estas lesiones afectan a más del 80% de los glomérulos y pueden lesionar al ovillo de forma segmentaria o generalizada.
No deberían verse depósitos subendoteliales ni epimembranosos, pero en la práctica hay algunos casos en los que se identifican pequeños depósitos subendoteliales, como extensión desde la región paramesangial.
Este patrón morfológico se ve en un 16% de las biopsias de enfermos con LES y generalmente aparece en pacientes con escasas manifestaciones clínicas o en fase de remisión.
Glomerulonefritis segmentaria y focal (Tipo III)
El 20% de las NL presentan este tipo de glomerulonefritis.
Consiste en lesiones de proliferación de células mesangiales, inflamación, necrosis y esclerosis segmentarias que afectan hasta el 50% de los glomérulos incluidos en la biopsia.
La inflamación está constituida por neutrófilos, muchos de ellos en apoptosis, con picnosis y kariorresis nuclear.
La necrosis es de tipo fibrinoide y con frecuencia engloba capilares glomerulares trombosados. A veces se acompaña de depósitos intracapilares de fibrina y de ruptura de la membrana basal.
La esclerosis consiste en cicatrices fibrosas, acelulares, generalmente adheridas a la cápsula de Bowman.
Las lesiones incluyen depósitos inmunes subendoteliales, que si son grandes forman las asas de alambre y podrán ser visibles con M.O.
En algunos casos son visibles trombos hialinos que son depósitos inmunes intracapilares.
Los cuerpos hematoxilínicos son los únicos hallazgos patognomónicos de la nefropatía lúpica. Sin embargo raramente se identifican y aparecen en menos del 2% de las biopsias. Son estructuras liláceas y consisten en núcleos desnudos cuya cromatina ha sido alterada por acúmulos de ANA.
Las semilunas epiteliales son un hallazgo habitual de la NL activa y habitualmente están en relación con lesiones necrotizantes. Pueden aparecer en ocasiones, en glomérulos con lesiones proliferativas endocapilares no necrotizantes.
Cicatrices glomerulares como dato de lesión crónica. Generalmente son focales y segmentarias, siguiendo la distribución de las lesiones necrotizantes y con frecuencia forman sinequias con la cápsula de Bowman.
Todas estas alteraciones se asocian a lesiones en lóbulos glomerulares «sanos», de otros tipos morfológicos, casi siempre de tipo II.
Glomerulonefritis proliferativa difusa (Tipo IV)
Las lesiones de esta nefropatía son idénticas a las descritas en el tipo III. La única diferencia radica en la gravedad y distribución de las mismas.
La proliferación endocapilar debe afectar a más del 50% de los glomérulos y éstos, están afectados globalmente. Puede haber algún lóbulo sin afectación endocapilar y al igual que sucede en la tipo III, éstos presentarán proliferación mesangial.
Las cicatrices fibrosas son más globales y difusas con glomérulos obsoletos. Estos glomérulos cicatriciales no son exclusivos de esta variedad patológica. Se pueden encontrar en los tipos III y IV. También pueden existir en la tipo V o aparecer como una complicación de la arterionefroesclerosis hipertensiva sin tener un origen inmune.
En la clasificación modificada de la OMS se recogen además de la glomerulonefritis endocapilar otras variantes morfológicas: la membranoproliferativa en la que las luces capilares están disminuidas por la interposición periférica de matriz mesangial y como consecuencia se dibuja un doble contorno de las membranas, pero sin oclusión completa de la luz. La proliferativa mesangial grave con depósitos subendoteliales difusos o extensos sin hipercelularidad. En todas ellas es imprescindible la presencia de depósitos subendoteliales para ser consideradas de tipo IV.
Glomerulonefritis membranosa (Tipo V)
Se caracteriza por la presencia de depósitos electrodensos de localización subepitelial, frecuentemente acompañados por una hipercelularidad mesangial leve-moderada.
Puesto que en las tipo III y IV pueden existir aislados y pequeños depósitos subepiteliales, el tipo V (membranosa) debe reservarse para los casos en que predominan dichos depósitos.
En la clasificación modificada de 1982 se incluyen dentro de este tipo cuatro subtipos (Va a Vd):
El subtipo Va es histológicamente indistinguible de la glomerulonefritis membranosa idiopática. El subtipo Vb denota una forma mixta de tipo V y Tipo II, que puede acompañarse o no de hipercelularidad mesangial (Tipo IIb o IIa).
La clase Vc es una combinación del tipo Va y III y el subtipo Vd combinación de Va y IV. Estos dos últimos subgrupos se han eliminado en 1995 ya que llamarlas Vc y Vd implicaría que predomina el componente membranoso sobre el proliferativo y en la práctica se ha visto que sucede todo lo contrario y que el pronóstico en ambos casos es sombrío y en cualquier caso mucho peor que el de la membranosa, por lo que es preferible etiquetarlos como formas mixtas Tipo IV y Tipo V.
Esclerosis avanzada (Tipo VI)
Esta variedad se recoge en la versión modificada de la OMS. En ella lo más característico es la esclerosis prácticamente difusa de la mayoría de los glomérulos incluidos en la biopsia.
Muchos de estos casos representan un Tipo IV avanzado.
En inmunofluorescencia y con microscopia electrónica se pueden encontrar residuos de pequeños depósitos electrondensos en las paredes de capilares glomerulares engrosadas, en el área tubulo-intersticial o en las paredes vasculares.
Nefritis tubulo-intersticial (figs. 6 y 7)
En el intersticio renal puede haber infiltrado mononuclear, constituido preferentemente por linfocitos T, con o sin plasmáticas y de algún polinuclear.
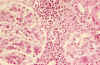
Fig. 6. Participación
túbulo-intersticial con densos infiltrados linfoplasmocitarios.
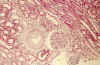
Fig. 7. Áreas
de fibrosis intersticial, con participación vascular y atrofia tubular focal
(Masson).
Su prevalencia, con relación al daño glomerular, aumenta desde el 14%, en los casos con glomerulonefritis tipo II, al 50% en la tipo IV. Su presencia es rara en la glomerulonefrits tipo V, donde sólo se observa en un 7% de los pacientes (13).
El infiltrado inflamatorio ocasionalmente se acompaña de fibrosis y daño tubular extenso.
Las lesiones tubulares que pueden existir son: desdoblamiento de la membrana basal, presencia de vacuolas hialinas en las células epiteliales del tubo contorneado proximal y ocasionalmente depósitos eosinófilos a lo largo de la membrana basal que se corresponden con depósitos finamente granulares de C3, IgG, IgA e IgM.
Al progresar la enfermedad aparece atrofia tubular que suele ser extensa en casos de larga evolución.
LESIONES VASCULARES
Son un hecho común de la NL (14). Pueden ser de morfología muy variable y aunque contribuyen a agravar la enfermedad y pueden influir en el pronóstico son ignoradas en la clasificación de la OMS.
Se encuentran depósitos inmunes en la NL tipo III y IV, en las paredes vasculares. Con menor frecuencia también se pueden ver en las tipo II y V. Se localizan en arterias pequeñas y arteriolas y más raramente en vénulas. Con M. Electrónica se demuestra su localización en la matriz extracelular de la media y en la membrana basal intimal. No parecen influir sin embargo, ni en la clínica ni en el pronóstico.
La vasculopatía lúpica es una lesión necrotizante, no inflamatoria que afecta a las arteriolas en muchos casos de NL tipo IV (15,16). Es un depósito de material fibrinoide en la íntima que puede llegar a ocluir su luz. Con frecuencia hay necrosis de células endoteliales y de miocitos en la media pero sin respuesta inflamatoria. Con inmunofluorescencia se observan depósitos de inmunoglobulinas y fibrinógeno en la íntima y en la media. Esta lesión se asocia a hipertensión y en estos enfermos la evolución a la insuficiencia renal suele ser rápida.
La microangiopatía trombótica (17) puede aparecer en cualquiera de las glomerulonefritis referidas. Hay trombosis fibrinoide en los capilares glomerulares y en los vasos, mesangiolisis y edema mucoide intimal con eritrocitos atrapados. No se suele asociar a depósitos inmunes.
Es rara en la NL la vasculitis necrotizante. Es, en todo, semejante a la observada en la panangeítis nodosa, con necrosis fibrinoide e inflamación. Tampoco se acompaña de depósitos inmunes.
Inmunofluorescencia (figs. 8 y 9)
La NL es una de las pocas enfermedades en las que se pueden encontrar depósitos inmunes en cualquiera de las estructuras renales: glomérulos, túbulos, intersticio y vasos.
En casi todos los casos (98%) hay depósitos intensos (2,5, en una escala de 0-3) de Ig G. En un 90% y 82% de los casos, con una menor intensidad, se identifican depósitos de Ig M e Ig A.
El C3 está presente en un 98% de las biopsias.
La presencia simultánea de inmunoglobulinas y C3, o alguno de sus componentes activos, es particularmente característico de NL (18).
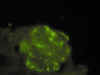
Fig. 8. Inmunofluorescencia:
depósitos de IgA subendoteliales, mesangiales y en menor cuantía, en paredes
capilares.

Fig. 9. Inmunofluorescencia:
depósitos de IgG, en paredes vasculares, con cierto patrón lobular y menos
intensos en mesangio.
Microscopia electrónica (fig. 10)
La distribución de los depósitos electrondensos se corresponden con los observados por inmunofluorescencia.

Fig. 10. Microscopia
electrónica: extensos depósitos, electrón densos, de localización
subendotelial y mesangial. Muy aislados subepiteliales.
Hay depósitos mesangiales en todos los casos de NL, excepto en el tipo I. Pueden ser por ello considerados como el sustrato común sobre el que se añaden otros depósitos.
Depósitos subendoteliales extensos. Además de los depósitos mesangiales, éstos son hallados habitualmente en la NL tipo III, con una distribución focal y segmentaria. Y al igual que sucede con la microscopia óptica, los depósitos subendoteliales son de distribución difusa y global en la tipo IV.
Puede haber depósitos subepiteliales pequeños y escasos en ausencia de patrón membranoso tanto en el tipo III como en el IV. En la NL tipo V estos depósitos son frecuentes, predominan sobre los demás y se acompañan de «spike» (púas de peine). Un hecho frecuente de la NL es la presencia de inclusiones tubulo-reticulares localizados en las cisternas del retículo endoplásmico de las células endoteliales.
FRECUENCIA Y CORRELACIÓN CLINICOPATOLÓGICA
La frecuencia de distribución de los diferentes tipos de nefritis en el LES en las diferentes series es variable y está condicionada por las indicaciones de biopsia renal que se siguen en cada Centro. La BR se suele realizar en los enfermos con manifestaciones clínicas relevantes y por este motivo las formas más frecuentes son el Tipo IV (38-50% de todos los casos biopsiados) seguidos de los Tipos II y III (15-20% para cada una) y por último el Tipo V (5-10%). El Tipo VI suele corresponder a la evolución de las formas anteriores (19).
Como ocurre con otras glomerulonefritis, no hay una correlación exacta entre el tipo de NL y las manifestaciones clínicas, la respuesta al tratamiento o el pronóstico. En general los tipo I y II cursan sin sintomatología clínica o con síntomas mínimos. El tipo III se suele asociar a alteraciones del sedimento urinario o a proteinuria no nefrótica. El tipo IV se presenta, por lo general, con manifestaciones clínicas más floridas (síndrome nefrítico, síndrome nefrótico con hematuria, y disminución de la función renal). El tipo V, con mucha frecuencia se acompaña de síndrome nefrótico.
El diagnóstico de LES se suele hacer con datos clínicos e inmunológicos, rara vez se necesita hacer una biopsia renal para confirmar el diagnóstico. La biopsia renal suele realizarse con fines pronósticos y terapéuticos. El principal objetivo de la misma es la identificación de lesiones que puedan predecir tanto la evolución de la enfermedad renal como la respuesta a los diferentes tratamientos.
En el momento actual el mejor uso de los corticoides y los citotóxicos ha mejorado la supervivencia. En un 20% de los pacientes con esta enfermedad, la insuficiencia renal será la causa de muerte.
BIBLIOGRAFÍA
Madaio MP. B cells and autoantiboides in the pathogenesis of lupus nephritis. Immunol Res 1998; 17: -123-32.
Churg J, Sobin LH. Lupus nephritis, in Renal disease: Classification and atlas of glomerular diseases. New York, Igaku-Shoin; 1982; 127-49.
Churg J, Bernstein J, Glassock R. Renal disease: Classification an atlas of glomerular disease (Second Edition), New York, Igaku-Shoin; 1995; 151-79.
Broijn JA, Verburgh CA, Huizinga T. Classifying lupus nephritis: A 32-year-old woman with systemic lupus erythematosus and nephritic syndrome. Am J Kidney Dis 2001; 37: 653-7.
Austin HA, Muenz LR, Joyce KM, Kullick ME, Klippel JH, Decker JL, Balow JE. Prognostic factors in lupus nephritis. Contribution of renal histologic data. Am J Med 1983; 75: 382-91.
Austin HA, Muenz LR, Joyce KM, Antonovych TT, Balow JE. Diffuse proliferative lupus nephritis; identification of specific pathologic features affecting renal outcome. Kidney Int 1984; 25: 689-95.
Scwartz MM, Lan S-P, Berostein J, Hill GS, Holley K, Lewis EJ. Irreproducibility of the activity and chronicity indices limits their utility in the management of lupus nephritis. Am J Kidney Dis 1993; 21: 374-7.
Austin HA, Boumpas DT, Vaughan EM, Balow JE. Predicting renal outcomes in severe lupus nephritis: contributions of clinical and histologic data. Kidney Int 1994; 45: 544-50.
Hill GS, Delahousse M, Nochy D, Tomkiewicz E, Rémy P, Mignon F, Mery JP. A new morphologic index for the evaluation of renal biopsies in lupus nephritis. Kidney Int 2000; 58: 1160-73.
Schwartz MM. The Holy grail: Pathological indices in lupus nephritis.Kidney Int 2000; 58: 1354-5.
Porter KA. The kidney in some selected systemic disease. Chapter 8 in: The kidney. Systemic pathology (third edition), v.8. Symmers (eds), Churchill Livingstone, New York 1992; 225-42.
D’Agati V. Renal disease in systemic lupus erythematosus, mixed connective tissue disease, Sjögren’s syndrome, and rheumatoid arthritis, in Jennette JC, Olson JL, Schwartz MM, et al (eds): Heptinstall’s Pathology of the Kidney (ed 5). Philadelphia, PA, Lippincott-Raven, 1998; 541-624.
Jerue J, Jurcic V, Vizjak A, Hvala A, Babic N, Kveder R, Praprotnik S, Ferloga D. Tubulointerstitial involvement in lupus nephritis with emphasis on pathogenesis. Wien Klin Wochenschr 2000; 112: 702-6.
Descombes E, Droz D, Drouet L, Grunfeld JP, Lesavre P. Renal vascular lesions in lupus nephri tis. Medicine (Baltimore) 1997; 76: 355-68.
Case records of the Massachusetts General Hospital: Rapidly progressive renal failure in a 35-year old woman with systemic lupus erythematosus. N Engl J Med 2001; 344: 1152-8.
Hughson MD, He Z, Henegar J, McMurray R. Alveolar hemorrhage and renal microangiopathy in systemic lupus erythematosus. Arch Pathol Lab Med 2001; 125: 475-83.
Bridoux F, Vrtovsnik F, Noel C, Saunier P, Mougenot B, Lemaitre V, Dracon M, Lelievre G, Vanhille P: Renal thrombotic microangiopathy in systemic lupus erythematosus: clinical correlations and longterm renal survival. Nephrol Dial Transplant 1998; 13: 298-304.
Ferluga D, Jerse M, Vizjak A, Hvala A, Rozman B, Kos-Golja M, Bren AF. Correlation among WHO classes, histomorphologic patterns of glomerulonephritis and glomerular immune deposits in SLE. Wien Klin Wochenschr 2000; 112: 692-701.
Najafi CC, Korbet SM, Lewis EJ, Schwart MM, Reichlin M, Evans J. Significance of histologic patterns of glomerular injury upon long-term prognosis in severe lupus glomerulonephritis. Kidney Int 2001; 59: 2156-63.